Wichtige Beweise aus klinischen Studien für Crisaborol
Einleitung Im Dezember 2016 hat die US-amerikanische Food and Drug Administration (FDA) die aktuelle Crisaborol-2%-Salbe (EUCRISA™, Anacor Pharmaceuticals, Kalifornien, USA) zur Behandlung von leichter bis mittelschwerer atopischer Dermatitis bei Patienten ab 2 Jahren zugelassen. Die Zulassung von Crisaborol basierte auf den Ergebnissen zweier […]
Wichtige Hinweise aus klinischen Studien für Cobimetinib
Was ist Cobimetinib? Cobimetinib ist ein verschreibungspflichtiges Medikament zur Behandlung von Melanomen, die sich auf andere Körperteile ausgebreitet haben, nicht operativ entfernt werden können und ein abnormales BRAF-Gen aufweisen. Es sollte nicht zur Behandlung von Melanomen bei Patienten mit Normal- oder Wildtyp angewendet werden. BRAF Gen. Im Jahr 2015 wurde die […]
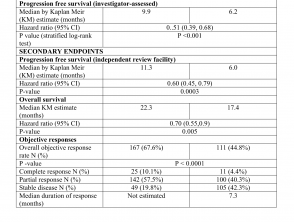
Wichtige Beweise aus klinischen Studien für Cemiplimab
Was ist Cemiplimab? Cemiplimab (auch Cemiplimab-rwlc genannt; Handelsname Libtayo®; Regeneron Pharmaceuticals Inc., New York, USA) ist ein monoklonaler Antikörper, der bei Patienten mit fortgeschrittenem kutanem Plattenepithelkarzinom (SCC) eingesetzt wird. Cemiplimab wurde von der US-amerikanischen Food and Drug Administration (FDA) für Patienten mit metastasiertem kutanem SCC oder kutanem SCC zugelassen.
Wichtige Hinweise aus klinischen Studien für Calcipotriol / Betamethason-Dipropionat-Schaum
Was ist Calcipotriol/Betamethasondipropionat-Schaum? Calcipotrioldipropionat/Betamethason-Schaum (Handelsname Enstilar®) ist ein Aerosolschaum mit doppelter Wirkung, der Calcipotriol, ein Vitamin-D-Analogon, und Betamethasondipropionat, ein Kortikosteroid, enthält. Calcipotriol ist in den USA als Calcipotrien bekannt. Calcipotriol-Schaum […]
Wichtige Beweise aus klinischen Studien für Brodalumab
Einleitung Brodalumab (Siliq™; Valeant Pharmaceuticals, New Jersey, USA) ist ein humaner monoklonaler IgG2-Antikörper, der selektiv an den humanen Interleukin-17 (IL-17)-Rezeptor bindet und dessen Wechselwirkungen mit einer Reihe von Zytokinen der IL-17-Familie hemmt . Brodalumab zielt auf den IL-17-Rezeptor ab, ein Zytokin oder Botenprotein, das in […] eingewickelt ist.
Wichtige Beweise aus klinischen Studien für Brimonidin
Einleitung Am 26. August 2013 hat die US-amerikanische Food and Drug Administration (FDA) das aktuelle Brimonidin (Mirvaso®)-Gel, 0,33%* (Galderma Laboratories, Texas, USA) für die topische Behandlung von anhaltendem (nicht vorübergehendem) Gesichtserythem zugelassen ( Rötung) von Rosacea bei Erwachsenen ab 18 Jahren. Es ist das erste und […]
Wichtige Beweise aus klinischen Studien für Apremilast
Einleitung Apremilast (Otezla®; Cellgene, New Jersey, USA) ist ein niedermolekularer Inhibitor des Enzyms Phosphodiesterase 4, das eine wichtige Rolle bei chronischen Entzündungen im Zusammenhang mit Psoriasis spielt. Am 23. September 2014 hat die US-amerikanische Food and Drug Administration (FDA) Apremilast für die Behandlung von Patienten mit Plaque-Psoriasis zugelassen.
Wichtige Beweise aus klinischen Studien für Alitretinoin
Orales Alitretinoin gegen Handekzeme Toctino® (Oral Alitretinoin) wird von Stiefel Laboratories (Großbritannien) vermarktet und ist für die Behandlung von Handekzemen im Vereinigten Königreich, Europa, Israel und Kanada zugelassen (Februar 2013). Die Sicherheit und Wirksamkeit von oralem Alitretinoin bei Patienten mit schwerem chronischem Handekzem, das auf die aktuellen […]
Wichtige Beweise aus klinischen Studien mit Dupilumab
Einleitung Es wurden drei entscheidende klinische Phase-3-Studien zur Untersuchung von Dupilumab bei der Behandlung von atopischer Dermatitis durchgeführt. Dupilumab (Dupixent™; Sanofi, Paris, Frankreich; Regeneron, New York, USA) hat in zwei zulassungsrelevanten Phase-3-Monotherapiestudien bei atopischer Dermatitis von […] eine wirksame Wirksamkeit und ein günstiges Sicherheitsprofil gezeigt.
Wichtige Beweise aus klinischen Studien für Tildrakizumab
Einleitung Im März 2018 erhielt Tildrakizumab (Ilumya™; Sun Pharma, Mumbai, Indien) die Zulassung der US-amerikanischen Food and Drug Administration (FDA) für die Behandlung mittelschwerer bis schwerer Erkrankungen. Plaque-Psoriasis bei Patienten, die für eine systemische Therapie oder Phototherapie in Frage kommen. Dieser monoklonale Antikörper bindet selektiv an die Untereinheit […]
