Einführung
Brodalumab (Siliq™;; Valeant Pharmaceuticals, NJ, USA) ist ein Mensch monoklonal IgG2 Antikörper das bindet selektiv an den Menschen Interleukin-17 (IL-17) Empfänger und hemmt Ihre Interaktionen mit einer Reihe von Zytokine der IL-17-Familie. Brodalumab zielt auf den IL-17-Rezeptor ab, der a Zytokin oder Bote Protein eingepackt in Entzündung was zu Psoriasis führt.
Im Februar 2017 erhielt Brodalumab die Zulassung der US-amerikanischen Food and Drug Administration (FDA) zur Behandlung von Psoriasis bei erwachsenen Patienten, die nicht auf andere Behandlungen angesprochen haben. Im Mai 2017 empfahl der Ausschuss für Humanarzneimittel der Europäischen Arzneimittel-Agentur die Erteilung einer Genehmigung für das Inverkehrbringen von Brodalumab zur Behandlung mittelschwerer bis schwerer Krankheiten. Nummernschild Psoriasis bei Erwachsenen, die Kandidaten für sind systemisch Therapie (Behandlung, bei der Substanzen verwendet werden, die nach dem Verschlucken oder Injizieren durch den Blutkreislauf wandern) oder Phototherapie (UV-Strahlung Behandlung).
Chronische Plaque-Psoriasis
Chronische Plaque-Psoriasis des Ellenbogens
Psoriasis der Kopfhaut
Chronische Plaque-Psoriasis
Wichtige Aufsätze zur Unterstützung der Wirksamkeit von Brodalumab
Die Zulassung von Brodalumab basierte auf drei Phase-3-Studien:
- AMAGINE-1 bewertete die Wirksamkeit, Sicherheit sowie den Entzugs- und Nachbehandlungseffekt von Brodalumab im Vergleich zu Placebo.
- AMAGINE-2 und AMAGINE-3 waren 12 Wochen Induktion Versuche gefolgt vonRandomisierung in Woche 12 und bewertete die Wirksamkeit und Sicherheit der Induktion und Erhaltung mit Brodalumab im Vergleich zu Ustekinumab und Placebo.
AMAGINE - 1
- AMAGINE - 1 war eine Phase 3, zufällig, Doppelblind, placebokontrollierte Studie, die eine 12-wöchige Induktionsphase gefolgt von einer Entzugs- / Nachbehandlungsphase von Woche 12 bis Woche 52 umfasst.
- Unter Verwendung einer 1: 1: 1-Randomisierung wurden 661 Patienten randomisiert und erhielten 12 Wochen lang alle zwei Wochen Injektionen von 210 mg Brodalumab (n = 222), 140 mg Brodalumab (n = 219) und Placebo (n = 220).
- In Woche 12 traten Patienten, die einen statischen Physician Global Assessment (sPGA) -Wert von 0 oder 1 erreichten, in die Entzugs- / Nachbehandlungsphase ein und wurden zufällig 1: 1 neu zugewiesen, um alle 2 Wochen 210 mg Brodalumab zu erhalten (n = 83) oder Placebo (n = 84) oder Brodalumab 140 mg alle 2 Wochen (n = 57) oder Placebo (n = 59).
- Alle anderen Patienten mit sPGA ≥ 2 erhielten alle 2 Wochen 210 mg Brodalumab (n = 208).
- Alle Patienten wurden bis Woche 52 beobachtet.
- In Woche 16 der Entzugs- / Nachbehandlungsphase wurden Patienten, bei denen eine Rückkehr der Krankheit auftrat (sPGA ≥ 3), erneut mit ihren Induktionsphasendosen von Brodalumab behandelt.
- Nach weiteren 12 Wochen der Nachbehandlung qualifizierten sich Patienten mit unzureichendem Ansprechen (sPGA ≥ 3) für die Bergungsbehandlung und erhielten öffnen Brodalumab 210 mg alle 2 Wochen.
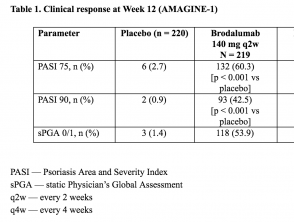
Ergebnisse - Woche 12 (AMAGINE - 1)
- In Woche 12 wurde die Co-primär Endpunkt einer 75%-Reduktion des Psoriasis-Bereichs und des Schwereindex-Scores (PASI 75) wurde bei 83% (95% [CI] 78-88), 60% (95% CI: 54-67) und 3% (95% CI: 1-6) von Patienten erreicht, die randomisiert auf 210 mg Brodalumab behandelt wurden alle 2 Wochen 140 mg Brodalumab alle 2 Wochen bzw. Placebo.
- Die entsprechenden Prozentsätze für den Erfolg von sPGA waren 76% (95% CI: 70-81), 54% (95% CI 47-61) und 1% (95% CI: 0-4) (p <0,001) para brodalumab 210 mg cada 2 semanas, brodalumab 140 mg cada 2 semanas y placebo, respectivamente.
- das Median Die Zeiten für das PASI 75-Ansprechen und den sPGA-Erfolg betrugen 4 und 6 Wochen bei Patienten, die randomisiert auf 210 mg Brodalumab bzw. 140 mg behandelt wurden.
- Krankenhausangst und Depression Rahmen Die Ergebnisse wurden in Woche 12 analysiert. Statistisch signifikante Abnahmen (p <0,001) en halb Eine Depression wurde bei Brodalumab 210 mg (5,5% bis 3,4%) und 140 mg (5,2% bis 3,5%) Dosen von beobachtet Base in Woche 12. Die Placebogruppe war unverändert (5,3% zu Studienbeginn und 5,5% in Woche 12).
Ergebnisse: Entzugs- / Nachbehandlungsphase (AMAGINE - 1)
- In Woche 52 betrug der Prozentsatz erfolgreicher sPGA-Patienten 83% und 0% für die Brodalumab 210 mg- bzw. Placebo-Gruppe (p <0,001 frente a placebo).
- In Woche 52 betrug der Prozentsatz erfolgreicher sPGA-Patienten 70% und 5% für die Brodalumab-140-mg- bzw. zufällig neu zugewiesenen Placebo-Gruppen (p <0,001 frente a placebo).
- Patienten mit erneutem Auftreten einer Krankheit (sPGA ≥ 3 in Woche 16) während der Entzugsphase konnten mit ihrer Induktionsdosis Brodalumab erneut behandelt werden.
- Unter diesen Patienten erreichten der 97%, der 210 mg Brodalumab erhielt, und der 84%, der 140 mg Brodalumab erhielt, nach 12-wöchiger Nachbehandlung einen sPGA-Wert von 0 oder 1.
- Die mediane Zeit, um den Erfolg von sPGA sowohl für 210 mg als auch für 140 mg Brodalumab wiederzugewinnen, betrug 4 Wochen.
Tabelle 1. Klinisches Ansprechen in Woche 12 (AMAGINE - 1)
Tabelle 1 - Klinisches Ansprechen in Woche 12 (AMAGINE - 1)
Nebenwirkungen - Woche 12 (AMAGINE - 1)
Die häufigsten unerwünschten Ereignisse (≥5% in einer Gruppe) in Woche 12 waren:
- Nasopharyngitis
- Obere Atemwege Infektion
- Kopfschmerzen.
Tabelle 2. Häufige unerwünschte Ereignisse in Woche 12 (AMAGINE-1)
Tabelle 2. Häufige unerwünschte Ereignisse in Woche 12 (AMAGINE-1)
In Woche 52 gab es vier tödliche unerwünschte Ereignisse: Dazu gehörten:
- Plötzlicher Tod bei einem Patienten, der 210 mg Brodalumab erhält (Induktions- und Nachbehandlungs- / Entzugsphase)
- Eine absichtliche Überdosierung illegaler Drogen, die vom Gerichtsmediziner als Selbstmord bei einem Patienten angesehen wird, der Placebo (Induktionsphase) und Brodalumab 210 mg (Entzugsphase) erhalten hat.
- EIN Speiseröhre Varizen Blutung bei einem Patienten mit einer Vorgeschichte von Zirrhose Erhalt von 210 mg Brodalumab (Induktions- und Entzugs- / Nachbehandlungsphase).
- EIN zerebrovaskulär Unfall bei einem Patienten, der 210 mg Brodalumab (Induktionsphase), Placebo (Entzugsphase) und 210 mg Brodalumab (Nachbehandlungsphase) erhielt.
AMAGINE - 2 und AMAGINE - 3
- AMAGINE-2 und AMAGINE-3 waren zwei große multinationale Phase-3-Parallelgruppen-Doppelblindstudien mit aktivem Komparator, die eine 12-wöchige Induktionsphase und eine 40-wöchige Wartungsphase umfassten.
- Während der 12-wöchigen Induktionsphase wurden die Patienten im Verhältnis 2: 2: 1: 1 randomisiert und erhielten alle 2 Wochen 210 mg Brodalumab oder 140 mg Ustekinumab (45 mg für Probanden) <100 kg de peso y 90 mg para sujetos> 100 kg) alle 4 Wochen oder Placebo.
Ergebnisse der Induktionsphase - Woche 12 (AMAGINE-2 und AMAGINE-3)
- Die Hauptziele waren die Bewertung der Überlegenheit von Brodalumab gegenüber Placebo in Woche 12 in Bezug auf das PASI 75-Ansprechen und einen sPGA-Score von 0 oder 1 (helle oder fast helle Haut) und die Überlegenheit von Brodalumab gegenüber Ustekinumab in Woche 12 mit bezüglich einer Reduktion von 100% in PASI 100.
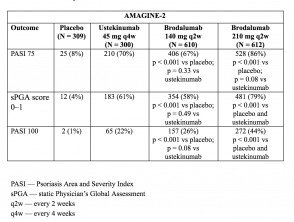
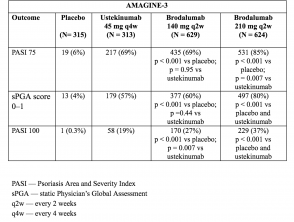
- In Woche 12 waren die PASI 75-Ansprechraten mit Brodalumab 210 mg und 140 mg höher als mit Placebo (86% bzw. 67% gegenüber 8% [AMAGINE-2] und 85% bzw. 69% gegenüber 6% [AMAGINE-3) ]; p <0,001).
- Die mediane Zeit bis zum Ansprechen auf PASI 75 betrug 4 Wochen für Brodalumab 210 mg gegenüber ungefähr 2 Monaten für Ustekinumab.
- Die Raten der sPGA-Werte von 0 oder 1 waren mit 210 mg Brodalumab gegenüber Ustekinumab ebenfalls höher (p <0,001).
- Die PASI 100-Ansprechraten in Woche 12 waren mit 210 mg Brodalumab signifikant höher als mit Ustekinumab (44% vs. 22% [AMAGINE - 2] und 37% vs. 19% [AMAGINE - 3]; p <0,001).
Tabellen 3 und 4. Klinisches Ansprechen in Woche 12 - AMAGINE-2 und AMAGINE-3
Tabelle 3. Klinisches Ansprechen in Woche 12 - AMAGINE-2
Tabelle 4. Klinisches Ansprechen in Woche 12 - AMAGINE-3
Ergebniswartungsphase: AMAGINE - 2 und AMAGINE - 3
- In Woche 12 wurden Patienten, die ursprünglich randomisiert wurden, um Brodalumab zu erhalten, wiederholt in einem Verhältnis von 2: 2: 2: 1 zu einem von vier Erhaltungsschemata randomisiert: Brodalumab 210 mg alle 2 Wochen; 140 mg alle 2 Wochen, 140 mg alle 4 Wochen oder 140 mg alle 8 Wochen, geschichtet nach Körpergewicht in Woche 12 (≤ 100 kg oder> 100 kg), Induktionsschema und Ansprechen in Woche 12 (geschichtet) sPGA-Punktzahl 0 oder ≥1).
- Patienten, die ursprünglich randomisiert wurden, um Placebo zu erhalten, wurden alle 2 Wochen auf 210 mg Brodalumab umgestellt, und Patienten, die ursprünglich randomisiert wurden, um Ustekinumab zu erhalten, erhielten Utekinumab weiterhin alle 12 Wochen bis Woche 52.
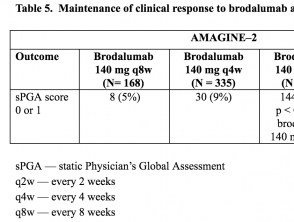
- In Woche 52 war der Anteil der Patienten mit einem sPGA-Wert von 0 oder 1 bei denjenigen, die alle 2 Wochen 210 mg oder 140 mg Brodalumab erhielten, signifikant höher als bei denjenigen, die die anderen Brodalumab-Erhaltungsschemata erhielten (p <0,001).
- PASI-Ansprechkurven über die Zeit für Patienten, die während der Studie 210 mg Brodalumab oder während der gesamten Studie Ustekinumab erhielten, zeigten, dass die Ansprechraten in Woche 12 anstiegen und sich in den Wochen 16 bis 52 stabilisierten.
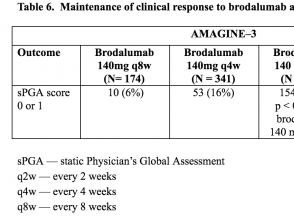
Tabellen 5 und 6. Aufrechterhaltung des klinischen Ansprechens auf Brodalumab in Woche 52 - AMAGINE-2 und AMAGINE-3
Tabelle 5. Aufrechterhaltung des klinischen Ansprechens auf Brodalumab in Woche 52 - AMAGINE-2
Tabelle 6. Aufrechterhaltung des klinischen Ansprechens auf Brodalumab in Woche 52 - AMAGINE-3
Unerwünschte Ereignisse: AMAGINE - 2 und AMAGINE - 3
- In der Induktionsphase waren die häufigsten unerwünschten Ereignisse Nasopharyngitis, Infektionen der oberen Atemwege, Kopfschmerzen und Arthralgie.
- Mit Ausnahme der Infektion der oberen Atemwege waren diese Ereignisse in der AMAGINE-2-Studie bei Brodalumab häufiger als bei Placebo oder Ustekinumab.
- Arthralgie war in der AMAGINE-3-Studie bei Brodalumab häufiger als bei Placebo oder Ustekinumab.
- Die Rate schwerwiegender unerwünschter Ereignisse pro 100 Patientenjahre bis Woche 52 betrug 8,3 mit Brodalumab und 13,0 mit Ustekinumab in der AMAGINE-2-Studie und 7,9 bzw. 4,0 in der AMAGINE-3-Studie. .
- Es gab keine klinisch offensichtlichen Unterschiede in der Art der schwerwiegenden unerwünschten Ereignisse zwischen den Studiengruppen.
- Candida Infektionen es trat während der Induktionsphase häufiger mit Brodalumab als mit Ustekinumab oder Placebo auf; Alle Infektionen wurden als leicht oder mittelschwer eingestuft und keine waren systemisch. Dieser Trend hielt bis Woche 52 an.
- Die Rate schwerwiegender infektiöser Ereignisse pro 100 Patientenjahre Exposition gegenüber Brodalumab bis Woche 52 betrug 1,0 in der AMAGINE-2-Studie und 1,3 in der AMAGINE-3-Studie; Die entsprechenden Raten mit Ustekinumab betrugen 0,8 und 1,2.
Brodalumab - Zukunftspotenzial
- Der IL-17-Zytokinweg spielt eine wichtige Rolle bei der Psoriasis.
- Drei Phase-3-Studien mit Brodalumab haben die wichtige Rolle des IL-17-Rezeptors bei mittelschwerer bis schwerer Psoriasis bestätigt.
- Brodalumab erwies sich als wirksam höher das von Placebo und Ustekinumab in Bezug auf die PASI 100-Reaktion in einem Vergleich von 210 mg Brodalumab alle 2 Wochen mit Ustekinumab.
- Die Behandlung mit Brodalumab führte zu einer raschen Verringerung der Anzeichen und Symptome von Psoriasis.
- Die mediane Zeit bis zur Reaktion auf PASI 75 betrug 4 Wochen mit 210 mg Brodalumab alle 2 Wochen, ungefähr doppelt so schnell wie die mediane Zeit bis zur Reaktion auf PASI 75 mit Ustekinumab.
- Brodalumab und andere Biologika der IL-17-Klasse könnten allein aufgrund ihrer Wirksamkeit die Erstlinientherapie bei mittelschwerer bis schwerer Plaque-Psoriasis sein.
- Sicherheitsüberlegungen in Bezug auf Depressionen und Suizidtendenzen könnten jedoch die Verwendung von Brodalumab zugunsten der anderen IL-17-Biologika Secukinumab und Ixekizumab behindern.
- Um ein umfassendes Verständnis des Sicherheitsprofils von Brodalumab zu erhalten, sind möglicherweise mehr klinische Studien mit einer großen Anzahl von Patienten und längeren Nachbeobachtungszeiträumen erforderlich.