introduzione
Brodalumab (Siliq™; Valeant Pharmaceuticals, NJ, USA) è un essere umano monoclonale IgG2 anticorpo che si lega selettivamente all'essere umano interleuchina-17 (IL-17) ricevitore e inibisce le tue interazioni con una serie di citochine della famiglia IL-17. Brodalumab prende di mira il recettore IL-17, che è a citochina o messenger proteina avvolto in infiammazione con conseguente psoriasi.
Nel febbraio 2017, brodalumab ha ricevuto l'approvazione dalla Food and Drug Administration (FDA) statunitense per il trattamento della psoriasi in pazienti adulti che non hanno risposto ad altri trattamenti. Nel maggio 2017, il comitato per i medicinali per uso umano dell'Agenzia europea per i medicinali ha raccomandato la concessione di un'autorizzazione all'immissione in commercio per brodalumab per il trattamento di malattie da moderate a gravi. targa psoriasi negli adulti candidati per sistemico terapia (trattamento che utilizza sostanze che viaggiano attraverso il flusso sanguigno, dopo essere state ingerite o iniettate) o fototerapia (Radiazioni ultraviolette trattamento).
Psoriasi cronica a placche
Psoriasi cronica a placche del gomito
Psoriasi del cuoio capelluto
Psoriasi cronica a placche
Saggi importanti a sostegno del efficacia di brodalumab
L'approvazione di brodalumab si è basata su tre studi di fase 3:
- AMAGINE-1 ha valutato l'efficacia, la sicurezza e l'effetto di sospensione e ripetizione del trattamento di brodalumab rispetto a placebo.
- AMAGINE-2 e AMAGINE-3 erano di 12 settimane induzione prove seguite darandomizzazione alla settimana 12 e ha valutato l'efficacia e la sicurezza dell'induzione e del mantenimento con brodalumab rispetto a ustekinumab e placebo.
AMAGINE - 1
- AMAGINE - 1 era una fase 3, randomizzato, doppio cieco, studio controllato con placebo che include una fase di induzione di 12 settimane seguita da una fase di ritiro / ritrattamento dalla settimana 12 alla settimana 52.
- Utilizzando la randomizzazione 1: 1: 1, 661 pazienti sono stati randomizzati a ricevere iniezioni bisettimanali di brodalumab 210 mg (n = 222), brodalumab 140 mg (n = 219) e placebo (n = 220) per 12 settimane.
- Alla settimana 12, i pazienti che hanno raggiunto un punteggio statico di valutazione globale del medico (sPGA) di 0 o 1 sono entrati nella fase di ritiro / ritrattamento e sono stati riassegnati in modo casuale 1: 1 a ricevere brodalumab 210 mg ogni 2 settimane (n = 83) o placebo (n = 84) o brodalumab 140 mg ogni 2 settimane (n = 57) o placebo (n = 59).
- Tutti gli altri pazienti con sPGA ≥ 2 hanno ricevuto brodalumab 210 mg ogni 2 settimane (n = 208).
- Tutti i pazienti sono stati seguiti fino alla settimana 52.
- Alla settimana 16 della fase di sospensione / ritrattamento, i pazienti che hanno manifestato una ricomparsa della malattia (sPGA ≥ 3) sono stati nuovamente trattati con le dosi della fase di induzione di brodalumab.
- Dopo altre 12 settimane di ripetizione del trattamento, quei pazienti con risposta inadeguata (sPGA ≥ 3), si sono qualificati per il trattamento di salvataggio e hanno ricevuto Aperto brodalumab 210 mg ogni 2 settimane.
Risultati - Settimana 12 (AMAGINE - 1)
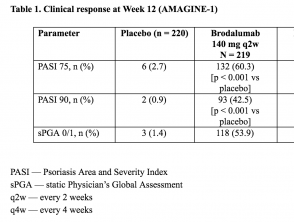
- Nella settimana 12, il co–primario punto finale di una riduzione di 75% nell'area della psoriasi e punteggio dell'indice di gravità (PASI 75) è stato ottenuto in 83% (95% [CI] 78-88), 60% (95% CI: 54-67) e 3% (95% CI: 1-6) di pazienti randomizzati a brodalumab 210 mg ogni 2 settimane, brodalumab 140 mg ogni 2 settimane e placebo, rispettivamente.
- Le percentuali corrispondenti per il successo di sPGA erano 76% (95% CI: 70-81), 54% (95% CI 47-61) e 1% (95% CI: 0-4) (p <0,001) para brodalumab 210 mg cada 2 semanas, brodalumab 140 mg cada 2 semanas y placebo, respectivamente.
- il mediano i tempi sia per la risposta PASI 75 che per il successo sPGA sono stati di 4 e 6 settimane nei pazienti randomizzati a brodalumab 210 mg e 140 mg, rispettivamente.
- Ansia e depressione ospedaliere Scala i punteggi sono stati analizzati alla settimana 12. Riduzioni statisticamente significative (p <0,001) en metà La depressione è stata osservata per le dosi di brodalumab 210 mg (da 5,5% a 3,4%) e 140 mg (da 5,2% a 3,5%) di base alla settimana 12. Il gruppo placebo è rimasto invariato (5,3% al basale e 5,5% alla settimana 12).
Risultati: fase di ritiro / ritrattamento (AMAGINE - 1)
- Alla settimana 52, le percentuali di pazienti sPGA riusciti erano 83% e 0% per i gruppi brodalumab 210 mg e placebo, rispettivamente (p <0,001 frente a placebo).
- Alla settimana 52, le percentuali di pazienti sPGA riusciti erano 70% e 5% per i gruppi brodalumab 140 mg e placebo riassegnati in modo casuale, rispettivamente (p <0,001 frente a placebo).
- I pazienti con recidiva della malattia (sPGA ≥ 3 alla settimana 16) durante la fase di sospensione si sono qualificati per il trattamento con la loro dose di induzione di brodalumab.
- Tra questi pazienti, il 97% che ha ricevuto brodalumab 210 mg e l'84% che ha ricevuto brodalumab 140 mg hanno raggiunto un punteggio sPGA di 0 o 1 dopo 12 settimane di ripetizione del trattamento.
- Il tempo mediano per riguadagnare il successo della sPGA sia per brodalumab 210 mg che per 140 mg è stato di 4 settimane.
Tabella 1. Risposta clinica alla settimana 12 (AMAGINE - 1)
Tabella 1 - Risposta clinica alla settimana 12 (AMAGINE - 1)
Eventi avversi - Settimana 12 (AMAGINE - 1)
Gli eventi avversi più comuni (≥5% in qualsiasi gruppo) alla settimana 12 sono stati:
- Nasofaringite
- Tratto respiratorio superiore infezione
- Mal di testa.
Tabella 2. Eventi avversi comuni alla settimana 12 (AMAGINE-1)
Tabella 2. Eventi avversi comuni alla settimana 12 (AMAGINE-1)
Ci sono stati quattro eventi avversi fatali fino alla settimana 52: questi includevano:
- Morte improvvisa in un paziente che riceve brodalumab 210 mg (fase di induzione e ritrattamento / sospensione)
- Un sovradosaggio intenzionale di droghe illecite considerato dal medico legale un suicidio in un paziente che ha ricevuto placebo (fase di induzione) e brodalumab 210 mg (fase di sospensione)
- UN esofageo varici emorragia in un paziente con una storia di cirrosi ricevere brodalumab 210 mg (fasi di induzione e sospensione / ritrattamento).
- UN cerebrovascolare incidente in un paziente che ha ricevuto brodalumab 210 mg (fase di induzione), placebo (fase di sospensione) e brodalumab 210 mg (fase di ritrattamento).
AMAGINE - 2 e AMAGINE - 3
- AMAGINE-2 e AMAGINE-3 erano due grandi studi multinazionali di fase 3, a gruppi paralleli, in doppio cieco, controllati con comparatore attivo che includevano una fase di induzione di 12 settimane e una fase di mantenimento di 40 settimane.
- Durante la fase di induzione di 12 settimane, i pazienti sono stati randomizzati utilizzando un rapporto 2: 2: 1: 1 per ricevere brodalumab 210 mg o 140 mg ogni 2 settimane, ustekinumab (45 mg per i soggetti <100 kg de peso y 90 mg para sujetos> 100 kg) ogni 4 settimane o placebo.
Risultati della fase di induzione - Settimana 12 (AMAGINE-2 e AMAGINE-3)
- Gli obiettivi principali erano valutare la superiorità di brodalumab rispetto al placebo alla settimana 12 rispetto alla risposta PASI 75 e un punteggio sPGA di 0 o 1 (pelle chiara o quasi), e la superiorità di brodalumab rispetto a ustekinumab alla settimana 12 con per quanto riguarda una riduzione di 100% in PASI 100.
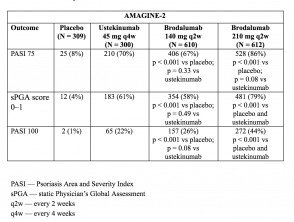
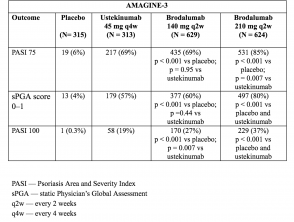
- Alla settimana 12, i tassi di risposta PASI 75 erano più alti con brodalumab 210 mg e 140 mg rispetto al placebo (86% e 67% rispettivamente, contro 8% [AMAGINE-2] e 85% e 69% rispettivamente, vs 6% [AMAGINE - 3 ]; p <0,001).
- Il tempo mediano alla risposta PASI 75 è stato di 4 settimane per brodalumab 210 mg rispetto a circa 2 mesi per ustekinumab.
- Anche i tassi di punteggi sPGA di 0 o 1 erano più alti con brodalumab 210 mg rispetto a ustekinumab (p <0,001).
- I tassi di risposta di PASI 100 alla settimana 12 erano significativamente più alti con 210 mg di brodalumab rispetto a ustekinumab (44% vs 22% [AMAGINE - 2] e 37% vs 19% [AMAGINE - 3]; p <0,001).
Tabelle 3 e 4. Risposta clinica alla settimana 12 - AMAGINE-2 e AMAGINE-3
Tabella 3. Risposta clinica alla settimana 12 - AMAGINE-2
Tabella 4. Risposta clinica alla settimana 12 - AMAGINE-3
Fase di mantenimento dei risultati: AMAGINE - 2 e AMAGINE - 3
- Alla settimana 12, i pazienti originariamente randomizzati a ricevere brodalumab sono stati sottoposti a ripetute randomizzazioni, in un rapporto di 2: 2: 2: 1, a uno dei quattro regimi di mantenimento: brodalumab 210 mg ogni 2 settimane, 140 mg ogni 2 settimane, 140 mg ogni 4 settimane o 140 mg ogni 8 settimane, stratificati per peso corporeo alla settimana 12 (≤ 100 kg o> 100 kg), regime di induzione e risposta alla settimana 12 ( Punteggio sPGA, 0 o ≥1).
- I pazienti che erano stati inizialmente randomizzati a ricevere il placebo sono passati a brodalumab 210 mg ogni 2 settimane e i pazienti che erano stati originariamente randomizzati a ricevere ustekinumab hanno continuato a ricevere ustekinumab ogni 12 settimane fino alla settimana 52.
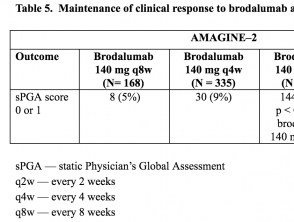
- Alla settimana 52, la percentuale di pazienti con un punteggio sPGA di 0 o 1 era significativamente più alta tra coloro che hanno ricevuto 210 mg o 140 mg di brodalumab ogni 2 settimane rispetto a quelli che hanno ricevuto gli altri regimi di mantenimento con brodalumab (p <0,001).
- Le curve di risposta PASI nel tempo per i pazienti che hanno ricevuto brodalumab 210 mg durante lo studio o ustekinumab durante lo studio hanno mostrato che i tassi di risposta sono aumentati durante la settimana 12 e si sono stabilizzati durante le settimane da 16 a 52.
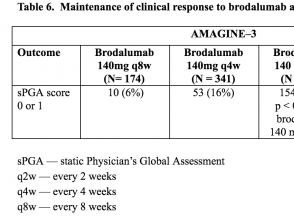
Tabelle 5 e 6. Mantenimento della risposta clinica a brodalumab alla settimana 52 - AMAGINE-2 e AMAGINE-3
Tabella 5. Mantenimento della risposta clinica a brodalumab alla settimana 52 - AMAGINE-2
Tabella 6. Mantenimento della risposta clinica a brodalumab alla settimana 52 - AMAGINE-3
Eventi avversi: AMAGINE - 2 e AMAGINE - 3
- Nella fase di induzione, gli eventi avversi più comuni sono stati rinofaringite, infezione del tratto respiratorio superiore, cefalea e artralgia.
- Ad eccezione dell'infezione del tratto respiratorio superiore, questi eventi sono stati più frequenti con brodalumab che con placebo o ustekinumab nello studio AMAGINE-2.
- L'artralgia era più comune con brodalumab che con placebo o ustekinumab nello studio AMAGINE-3.
- Le percentuali di eventi avversi gravi per 100 anni-paziente fino alla settimana 52 sono state 8,3 con brodalumab e 13,0 con ustekinumab nello studio AMAGINE-2 e 7,9 e 4,0, rispettivamente, nello studio AMAGINE-3. .
- Non c'erano differenze clinicamente evidenti nei tipi di eventi avversi gravi tra i gruppi di studio.
- Candida infezioni si è verificato più frequentemente con brodalumab che con ustekinumab o placebo durante la fase di induzione; tutte le infezioni sono state classificate come lievi o moderate e nessuna era sistemica. Questa tendenza è continuata fino alla settimana 52.
- I tassi di eventi infettivi gravi per 100 anni-paziente di esposizione a brodalumab fino alla settimana 52 sono stati 1,0 nello studio AMAGINE-2 e 1,3 nello studio AMAGINE-3; le percentuali corrispondenti con ustekinumab erano 0,8 e 1,2.
Brodalumab: potenziale futuro
- La via delle citochine IL-17 gioca un ruolo importante nella psoriasi.
- Tre studi di fase 3 con brodalumab hanno convalidato l'importante ruolo del recettore IL-17 nella psoriasi da moderata a grave.
- Brodalumab ha dimostrato di essere efficace più alto quello di placebo e ustekinumab rispetto alla risposta PASI 100 in un confronto di brodalumab 210 mg ogni 2 settimane con ustekinumab.
- Il trattamento con Brodalumab ha determinato una rapida riduzione dei segni e dei sintomi della psoriasi.
- Il tempo mediano alla risposta PASI 75 è stato di 4 settimane con brodalumab 210 mg ogni 2 settimane, circa due volte più veloce del tempo mediano alla risposta PASI 75 con ustekinumab.
- Basandosi esclusivamente sull'efficacia, brodalumab e altri farmaci biologici di classe IL-17 potrebbero diventare la terapia di prima linea per la psoriasi a placche da moderata a grave.
- Tuttavia, considerazioni sulla sicurezza in relazione alla depressione e alle tendenze suicide potrebbero ostacolare l'uso di brodalumab a favore degli altri farmaci biologici IL-17, secukinumab e ixekizumab.
- Per fornire una piena comprensione del profilo di sicurezza di brodalumab, possono essere necessari più studi clinici che coinvolgono un gran numero di pazienti e periodi di follow-up più lunghi.