Introducción
Brodalumab (Siliq™; Valeant Pharmaceuticals, Nueva Jersey, EE. UU.) Es un ser humano monoclonal IgG2 anticuerpo que se une selectivamente al ser humano interleucina-17 (IL-17) receptor e inhibe sus interacciones con una serie de citocinas de la familia IL-17. Brodalumab se dirige al receptor de IL-17, que es un citocina o mensajero proteína envuelto en inflamación resultando en psoriasis.
En febrero de 2017, brodalumab recibió la aprobación de la Administración de Drogas y Alimentos de los EE. UU. (FDA) para tratar la psoriasis en pacientes adultos que no han respondido a otros tratamientos. En mayo de 2017, el Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos recomendó la concesión de una autorización de comercialización de brodalumab para el tratamiento de enfermedades moderadas a graves. placa psoriasis en adultos que son candidatos a sistémico terapia (tratamiento que utiliza sustancias que viajan por el torrente sanguíneo, después de ser ingeridas o inyectadas) o fototerapia (Radiación ultravioleta tratamiento).
Psoriasis crónica en placas
Psoriasis crónica en placas del codo
Psoriasis del cuero cabelludo
Psoriasis crónica en placas
Ensayos importantes que apoyan la eficacia de brodalumab
La aprobación de brodalumab se basó en tres ensayos de fase 3:
- AMAGINE-1 evaluó la eficacia, la seguridad y el efecto de retirada y retratamiento de brodalumab en comparación con placebo.
- AMAGINE-2 y AMAGINE-3 fueron 12 semanas inducción ensayos seguidos dealeatorización en la semana 12 y evaluaron la eficacia y seguridad de la inducción y el mantenimiento con brodalumab en comparación con ustekinumab y placebo.
AMAGINE – 1
- AMAGINE – 1 fue una fase 3, aleatorizado, doble ciego, ensayo controlado con placebo que incluye una fase de inducción de 12 semanas seguida de una fase de retirada / retratamiento desde la semana 12 hasta la 52.
- Utilizando una aleatorización 1: 1: 1, 661 pacientes fueron aleatorizados para recibir inyecciones quincenales de brodalumab 210 mg (n = 222), brodalumab 140 mg (n = 219) y placebo (n = 220) durante 12 semanas.
- En la semana 12, los pacientes que alcanzaron una puntuación de Evaluación Global del Médico (sPGA) estática de 0 o 1 entraron en la fase de retiro / retratamiento y fueron reasignados al azar 1: 1 para recibir brodalumab 210 mg cada 2 semanas (n = 83) o placebo (n = 84 ) o brodalumab 140 mg cada 2 semanas (n = 57) o placebo (n = 59).
- Todos los demás pacientes con sPGA ≥ 2 recibieron brodalumab 210 mg cada 2 semanas (n = 208).
- Todos los pacientes fueron seguidos hasta la semana 52.
- En la semana 16 de la fase de retirada / retratamiento, los pacientes que experimentaron un retorno de la enfermedad (sPGA ≥ 3) fueron tratados nuevamente con sus dosis de la fase de inducción de brodalumab.
- Después de 12 semanas más de retratamiento, aquellos pacientes con respuesta inadecuada (sPGA ≥ 3), calificaron para el tratamiento de rescate y recibieron abierto brodalumab 210 mg cada 2 semanas.
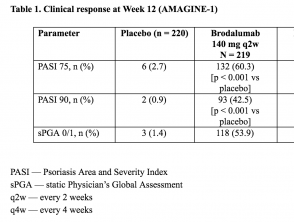
Resultados – Semana 12 (AMAGINE – 1)
- En la semana 12, el co–primario punto final de una reducción del 75% en la puntuación del índice de gravedad y área de psoriasis (PASI 75) se logró en un 83% (intervalo de confianza del 95% [CI] 78-88), 60% (IC del 95%: 54-67) y 3% (IC del 95%: 1-6) de los pacientes aleatorizados a brodalumab 210 mg cada 2 semanas, brodalumab 140 mg cada 2 semanas y placebo, respectivamente.
- Los porcentajes correspondientes para el éxito de la sPGA fueron 76% (95% CI: 70-81), 54% (95% CI 47-61) y 1% (95% CI: 0-4) (p <0,001) para brodalumab 210 mg cada 2 semanas, brodalumab 140 mg cada 2 semanas y placebo, respectivamente.
- los mediana los tiempos tanto para la respuesta PASI 75 como para el éxito de la sPGA fueron de 4 y 6 semanas en los pacientes aleatorizados a brodalumab 210 mg y 140 mg, respectivamente.
- Ansiedad y depresión hospitalaria Escala las puntuaciones se analizaron en la semana 12. Disminuciones estadísticamente significativas (p <0,001) en media Se observaron depresión para brodalumab 210 mg (5,5% a 3,4%) y 140 mg (5,2% a 3,5%) dosis de base en la semana 12. El grupo de placebo no se modificó (5,3% al inicio y 5,5% en la semana 12).
Resultados: fase de retirada / retratamiento (AMAGINE – 1)
- En la semana 52, los porcentajes de pacientes con éxito de sPGA fueron 83% y 0% para los grupos de brodalumab 210 mg y placebo, respectivamente (p <0,001 frente a placebo).
- En la semana 52, los porcentajes de pacientes con éxito de la sPGA fueron del 70% y del 5% para los grupos de brodalumab 140 mg y placebo reasignados al azar, respectivamente (p <0,001 frente a placebo).
- Los pacientes con reaparición de la enfermedad (sPGA ≥ 3 en la semana 16) durante la fase de retirada calificaron para un retratamiento con su dosis de inducción de brodalumab.
- Entre estos pacientes, el 97% que recibieron brodalumab 210 mg y el 84% que recibieron brodalumab 140 mg alcanzaron una puntuación sPGA de 0 o 1 después de 12 semanas de retratamiento.
- La mediana de tiempo para recuperar el éxito de la sPGA tanto para brodalumab 210 mg como para 140 mg fue de 4 semanas.
Tabla 1. Respuesta clínica en la semana 12 (AMAGINE – 1)
Tabla 1 – Respuesta clínica en la semana 12 (AMAGINE – 1)
Eventos adversos – Semana 12 (AMAGINE – 1)
Los eventos adversos más frecuentes (≥ 5% en cualquier grupo) en la semana 12 fueron:
- Nasofaringitis
- Tracto respiratorio superior infección
- Dolor de cabeza.
Tabla 2. Eventos adversos comunes en la semana 12 (AMAGINE-1)
Tabla 2. Eventos adversos comunes en la semana 12 (AMAGINE-1)
Hubo cuatro eventos adversos fatales hasta la semana 52: estos incluyeron:
- Muerte súbita en un paciente que recibe brodalumab 210 mg (fase de inducción y retratamiento / retirada)
- Una sobredosis intencional de drogas ilícitas considerada por el médico forense como suicidio en un paciente que recibió placebo (fase de inducción) y brodalumab 210 mg (fase de abstinencia)
- Un esofágico variceal hemorragia en un paciente con antecedentes de cirrosis recibiendo brodalumab 210 mg (fases de inducción y retirada / retratamiento).
- UNA cerebrovascular accidente en un paciente que recibió brodalumab 210 mg (fase de inducción), placebo (fase de retirada) y brodalumab 210 mg (fase de retratamiento).
AMAGINE – 2 y AMAGINE – 3
- AMAGINE-2 y AMAGINE-3, fueron dos grandes ensayos de fase 3 multinacionales, de grupo paralelo, doble ciego, controlados con comparador activo, que incluían una fase de inducción de 12 semanas y una fase de mantenimiento de 40 semanas.
- Durante la fase de inducción de 12 semanas, los pacientes fueron aleatorizados utilizando una proporción de 2: 2: 1: 1 para recibir brodalumab 210 mg o 140 mg cada 2 semanas, ustekinumab (45 mg para sujetos <100 kg de peso y 90 mg para sujetos> 100 kg) cada 4 semanas o placebo.
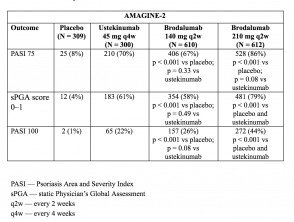
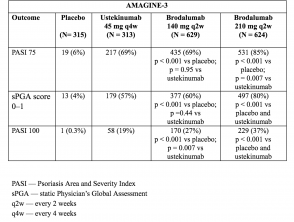
Resultados de la fase de inducción – Semana 12 (AMAGINE-2 y AMAGINE-3)
- Los objetivos principales fueron evaluar la superioridad de brodalumab sobre placebo en la semana 12 con respecto a la respuesta PASI 75 y una puntuación sPGA de 0 o 1 (piel clara o casi clara), y la superioridad de brodalumab sobre ustekinumab en la semana 12 con respecto a una reducción del 100% en PASI 100.
- En la semana 12, las tasas de respuesta PASI 75 fueron más altas con brodalumab 210 mg y 140 mg que con placebo (86% y 67% respectivamente, frente a 8% [AMAGINE-2] y 85% y 69% respectivamente, vs 6% [AMAGINE–3]; p <0,001).
- La mediana del tiempo hasta la respuesta PASI 75 fue de 4 semanas para brodalumab 210 mg versus aproximadamente 2 meses para ustekinumab.
- Las tasas de puntuaciones de sPGA de 0 o 1 también fueron más altas con brodalumab 210 mg frente a ustekinumab (p <0,001).
- Las tasas de respuesta PASI 100 en la semana 12 fueron significativamente más altas con 210 mg de brodalumab que con ustekinumab (44% frente a 22% [AMAGINE–2] y 37% vs 19% [AMAGINE–3]; p <0,001).
Tablas 3 y 4. Respuesta clínica en la semana 12 – AMAGINE-2 y AMAGINE-3
Tabla 3. Respuesta clínica en la semana 12 – AMAGINE-2
Tabla 4. Respuesta clínica en la semana 12 – AMAGINE-3
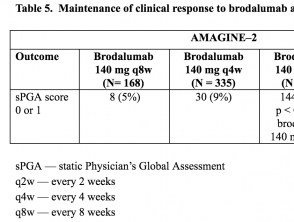
Fase de mantenimiento de resultados: AMAGINE – 2 y AMAGINE – 3
- En la semana 12, los pacientes que originalmente fueron asignados al azar para recibir brodalumab se sometieron a una aleatorización repetida, en una proporción de 2: 2: 2: 1, a uno de cuatro regímenes de mantenimiento: brodalumab 210 mg cada 2 semanas, 140 mg cada 2 semanas, 140 mg cada 4 semanas, o 140 mg cada 8 semanas, estratificado según el peso corporal de la semana 12 (≤ 100 kg o> 100 kg), el régimen de inducción y la respuesta a la semana 12 (puntuación sPGA, 0 o ≥1).
- Los pacientes que originalmente fueron asignados al azar para recibir placebo se cambiaron a brodalumab 210 mg cada 2 semanas y los pacientes que originalmente fueron asignados al azar para recibir ustekinumab continuaron recibiendo ustekinumab cada 12 semanas hasta la Semana 52.
- En la semana 52, la proporción de pacientes con una puntuación sPGA de 0 o 1 fue significativamente mayor entre los que recibieron brodalumab 210 mg o 140 mg cada 2 semanas que entre los que recibieron los otros regímenes de mantenimiento de brodalumab (p <0,001).
- Las curvas de respuesta PASI a lo largo del tiempo para los pacientes que recibieron brodalumab 210 mg durante el estudio o ustekinumab durante todo el estudio mostraron que las tasas de respuesta aumentaron hasta la semana 12 y se estabilizaron durante las semanas 16 a 52.
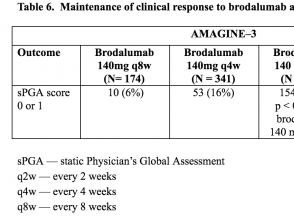
Tablas 5 y 6. Mantenimiento de la respuesta clínica a brodalumab en la semana 52 – AMAGINE-2 y AMAGINE-3
Tabla 5. Mantenimiento de la respuesta clínica a brodalumab en la semana 52 – AMAGINE-2
Tabla 6. Mantenimiento de la respuesta clínica a brodalumab en la semana 52 – AMAGINE-3
Eventos adversos: AMAGINE – 2 y AMAGINE – 3
- En la fase de inducción, los eventos adversos más comunes fueron nasofaringitis, infección del tracto respiratorio superior, dolor de cabeza y artralgia.
- Con la excepción de la infección del tracto respiratorio superior, estos eventos fueron más frecuentes con brodalumab que con placebo o ustekinumab en el estudio AMAGINE-2.
- La artralgia fue más frecuente con brodalumab que con placebo o ustekinumab en el estudio AMAGINE-3.
- Las tasas de eventos adversos graves por 100 pacientes-año hasta la semana 52 fueron 8,3 con brodalumab y 13,0 con ustekinumab en el estudio AMAGINE-2 y 7,9 y 4,0, respectivamente, en el estudio AMAGINE-3.
- No hubo diferencias clínicamente aparentes en los tipos de eventos adversos graves entre los grupos de estudio.
- Candida infecciones ocurrió con más frecuencia con brodalumab que con ustekinumab o placebo durante la fase de inducción; todas las infecciones se clasificaron como leves o moderadas y ninguna fue sistémica. Esta tendencia continuó hasta la semana 52.
- Las tasas de episodios infecciosos graves por 100 pacientes-año de exposición a brodalumab hasta la semana 52 fueron 1,0 en el estudio AMAGINE-2 y 1,3 en el estudio AMAGINE-3; las tasas correspondientes con ustekinumab fueron 0,8 y 1,2.
Brodalumab - potencial futuro
- La vía de las citocinas IL-17 juega un papel importante en la psoriasis.
- Tres estudios de fase 3 con brodalumab han validado el importante papel del receptor de IL-17 en la psoriasis de moderada a grave.
- Se demostró que brodalumab tiene eficacia superior al de placebo y ustekinumab con respecto a la respuesta PASI 100 en una comparación de brodalumab 210 mg cada 2 semanas con ustekinumab.
- El tratamiento con Brodalumab resultó en una rápida reducción de los signos y síntomas de la psoriasis.
- El tiempo medio hasta una respuesta PASI 75 fue de 4 semanas con brodalumab 210 mg cada 2 semanas, aproximadamente el doble de rápido que el tiempo medio hasta una respuesta PASI 75 con ustekinumab.
- Basándose únicamente en la eficacia, brodalumab y otros productos biológicos de la clase IL-17 podrían convertirse en la terapia de primera línea para la psoriasis en placas de moderada a grave.
- Sin embargo, las consideraciones de seguridad en relación con la depresión y las tendencias suicidas podrían obstaculizar el uso de brodalumab en favor de los otros productos biológicos de IL-17, secukinumab e ixekizumab.
- Para proporcionar una comprensión completa del perfil de seguridad de brodalumab, pueden ser necesarios más ensayos clínicos que incluyan un gran número de pacientes y períodos de seguimiento más prolongados.