30 de enero de 2020 – Reino Unido y Europa suspenden la comercialización de Picato® Gel.
Agencia Reguladora de Medicamentos y Productos Sanitarios, Reino Unido [1] y la Agencia Europea de Medicamentos (EMA) [2] han anunciado que se ha suspendido la comercialización del gel Picato® que contiene mebutato de ingenol. Han recomendado que los pacientes dejen de usar el producto en espera de una investigación sobre su seguridad con respecto a la piel. cáncer.
Ver más:
- La comercialización europea de Picato se suspende mientras se revisa el riesgo de cáncer de piel. 17 de enero de 2020. Medscape Medical News.
- Medicamentos de clase 2 Recordar: LEO Laboratories Ltd, Picato 150 mcg / g gel. 27 de enero de 2020. Gobernador del Reino Unido
Introducción
La aprobación de la FDA para el uso del gel de mebutato de ingenol se basó en datos de cuatro estudios de fase III en más de 1000 personas que muestran que el gel de mebutato de ingenol aplicado una vez al día durante dos o tres días consecutivos es significativamente más efectivo que placebo al despejar actínico queratosis.
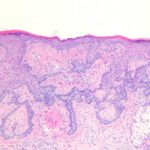
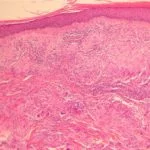
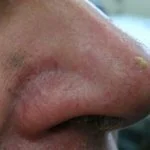
Actínico queratosis de la cara y el cuero cabelludo
En dos doble ciego, vehículo-en ensayos clínicos controlados, 547 sujetos adultos con queratosis actínica en la cara o el cuero cabelludo fueron aleatorizado al tratamiento con gel de mebutato de ingenol al 0,015% o gel vehículo durante 3 días consecutivos, seguido de un período de seguimiento de 8 semanas.
Los estudios incluyeron sujetos con 4 a 8 clínicamente típicos, visibles, discreto queratosis actínicas dentro de 25 cm2 Área de tratamiento contigua.
En cada día de dosificación programado, el gel de estudio se aplicó a toda el área de tratamiento. Un total de 536 sujetos (98%) completaron estos estudios. Los sujetos del estudio tenían entre 34 y 89 años de edad (media 64 años). Aproximadamente el 85% de los sujetos eran hombres y todos los sujetos tratados con ingenol mebutato eran caucásicos.
Eficacia se evaluó el día 57. La tasa de eliminación completa se definió como la proporción de sujetos sin queratosis actínicas clínicamente visibles en el área de tratamiento.
La tasa de aclaramiento parcial se definió como la proporción de sujetos con una reducción del 75% o más en el número de queratosis actínicas. lesiones a base en el área de tratamiento seleccionada.
Los resultados clave se tabulan a continuación.
| Estudio 1 | Estudio 2 | |||
|---|---|---|---|---|
| Gel de mebutato de ingenol, 0,015% (n = 135) | Vehículo (n = 134) | Gel de mebutato de ingenol, 0,015% (n = 142) | Vehículo (n = 136) | |
| Eliminación total completa el día 57 | 50 (37%) | 3 (2%) | 67 (47%) | 7 (5%) |
| Eliminación total parcial el día 57 | 81 (60%) | 9 (7%) | 96 (68%) | 11 (8%) |
| Eliminación completa de las lesiones del cuero cabelludo (día 57) | 4/26 (15%) | 0/25 (0%) | 31/9 (29%) | 1/25 (4%) |
| Eliminación completa de lesiones faciales (día 57) | 46/109 (42%) | 3/109 (2%) | 58/111 (52%) | 6/111 (5%) |
- Los sujetos que lograron una eliminación completa el día 57 en el Estudio 1 y el Estudio 2 entraron en un período de seguimiento de 12 meses.
- Basado en 108 sujetos tratados con ingenol mebutato en gel que lograron un aclaramiento completo en el Estudio 1 y el Estudio 2, el reaparición la tasa a los 12 meses fue del 54%.
- La recurrencia se definió como el porcentaje de sujetos con cualquier queratosis actínica identificada en el área previamente tratada que lograron una eliminación completa el día 57.
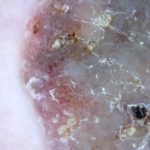
Queratosis actínica del tronco y extremidades
En dos ensayos clínicos doble ciego controlados con vehículo, 458 sujetos adultos con queratosis actínica en el tronco o las extremidades fueron aleatorizados para recibir tratamiento con ingenol mebutato en gel al 0,05% o en gel vehículo durante 2 días consecutivos, seguido de un seguimiento de 8 semanas. -período. Los estudios incluyeron sujetos con 4 a 8 lesiones de queratosis actínica discretas, visibles y clínicamente típicas dentro de un radio de 25 cm.2 Área de tratamiento contigua. Hipertrófico y hiperqueratósico las lesiones fueron excluidas del tratamiento. En cada día de dosificación programado, el gel de estudio se aplicó a toda el área de tratamiento. Un total de 447 sujetos (98%) completaron estos estudios. Los sujetos del estudio tenían entre 34 y 89 años (media de 66 años).
Aproximadamente el 62% de los sujetos eran hombres y todos los sujetos tratados con ingenol mebutato eran caucásicos.
Las tasas de aclaramiento completo y parcial se definieron como en el estudio 1.
Los resultados clave se tabulan a continuación.
| Estudio 3 | Estudio 4 | |||
|---|---|---|---|---|
| Gel de mebutato de ingenol, 0,05% (n = 126) | Vehículo (n = 129) | Gel de mebutato de ingenol, 0,05% (n = 100) | Vehículo (n = 103) | |
| Eliminación total completa el día 57 | 35 (28%) | sesenta y cinco%) | 42 (42%) | 5 (5%) |
| Aclaramiento parcial global el día 57 (≥75%) | 56 (44%) | 9 (7%) | 55 (55%) | 7 (7%) |
| Lesiones del brazo con aclaramiento completo (RC) (día 57) | 22/84 (26%) | 4/82 (5%) | 27/59 (46%) | 3/67 (5%) |
| Lesiones de mano CR (día 57) | 4/25 (16%) | 0/29 (0%) | 6/28 (21%) | 0/27 (0%) |
| Lesiones torácicas CR (día 57) | 8/9 (89%) | 1/8 (13%) | 3/5 (60%) | 1/3 (33%) |
| CR (pierna / hombro / espalda) | 1/8 (13%) | 1/10 (10%) | 6/8 (75%) | 1/6 (17%) |
- Los sujetos que lograron una eliminación completa el día 57 en el estudio 4 ingresaron a un período de seguimiento de 12 meses. En base a 38 sujetos tratados con ingenol mebutato en gel que lograron una eliminación completa en el estudio 4, la tasa de recurrencia a los 12 meses fue del 50%.
- La recurrencia se definió como el porcentaje de sujetos con queratosis actínica identificada lesión en el área previamente tratada que logró un aclaramiento completo el día 57.
No se han realizado estudios a largo plazo en animales para evaluar la carcinogénico potencial del mebutato de ingenol.
No se han evaluado los efectos del mebutato de ingenol sobre la fertilidad.
Uso en ancianos
- De 1165 sujetos tratados con ingenol mebutato gel en ensayos clínicos, el 56% tenía 65 años o más y el 21% tenía 75 años o más.
- No se observaron diferencias generales en seguridad o eficacia entre estos sujetos y sujetos más jóvenes.
Más información
Regrese a la página de ingenol mebutato en gel.