Invoering
Brodalumab (siliq™; Valeant Pharmaceuticals, New Jersey, VS) is een mens monoklonaal IgG2 antilichaam dat zich selectief aan mensen bindt interleukine-17 (IL-17) ontvanger en remt de interacties ervan met een reeks van cytokinen van de IL-17-familie. Brodalumab richt zich op de IL-17-receptor, een cytokine of boodschapper eiwit ingepakt in ontsteking resulterend in psoriasis.
In februari 2017 kreeg brodalumab goedkeuring van de Amerikaanse Food and Drug Administration (FDA) voor de behandeling van psoriasis bij volwassen patiënten die niet op andere behandelingen reageerden. In mei 2017 adviseerde het Comité voor geneesmiddelen voor menselijk gebruik van het Europees Geneesmiddelenbureau de verlening van een vergunning voor het in de handel brengen van brodalumab voor de behandeling van matige tot ernstige ziekten. nummerplaat psoriasis bij volwassenen die hiervoor in aanmerking komen systemisch therapie (behandeling waarbij gebruik wordt gemaakt van stoffen die door de bloedbaan reizen, nadat ze zijn ingenomen of geïnjecteerd) of fototherapie (ultraviolette straling behandeling).
Chronische plaque psoriasis
Chronische plaque psoriasis van de elleboog
Hoofdhuid psoriasis
Chronische plaque psoriasis
Belangrijke proeven ter ondersteuning van de effectiviteit van brodalumab
De goedkeuring van brodalumab was gebaseerd op drie fase 3-onderzoeken:
- AMAGINE-1 evalueerde de werkzaamheid, veiligheid en het ontwennings- en herbehandelingseffect van brodalumab in vergelijking met placebo.
- AMAGINE-2 en AMAGINE-3 waren 12 weken inductie beproevingen gevolgd doorrandomisatie in week 12 en evalueerde de werkzaamheid en veiligheid van inductie en onderhoud met brodalumab in vergelijking met ustekinumab en placebo.
AMAGINE – 1
- AMAGINE – 1 was een fase 3, gerandomiseerd, dubbelblind, placebogecontroleerd onderzoek met een inductiefase van 12 weken gevolgd door een fase van stopzetting/herbehandeling van week 12 tot 52.
- Met behulp van een 1:1:1-randomisatie werden 661 patiënten gerandomiseerd naar tweewekelijkse injecties met brodalumab 210 mg (n = 222), brodalumab 140 mg (n = 219) en placebo (n = 220) gedurende 12 weken.
- In week 12 gingen patiënten die een statische Physician Global Assessment (sPGA)-score van 0 of 1 behaalden de fase van stopzetting/herbehandeling in en werden 1:1 gerandomiseerd naar brodalumab 210 mg elke 2 weken (n = 83) of placebo (n = 84) of brodalumab 140 mg elke 2 weken (n = 57) of placebo (n = 59).
- Alle andere patiënten met sPGA ≥ 2 kregen elke 2 weken 210 mg brodalumab (n = 208).
- Alle patiënten werden gevolgd tot week 52.
- In week 16 van de stopzettings-/herbehandelingsfase werden patiënten bij wie de ziekte terugkeerde (sPGA ≥ 3) opnieuw behandeld met hun doses brodalumab in de inductiefase.
- Na nog eens twaalf weken herbehandeling kwamen de patiënten met een ontoereikende respons (sPGA ≥ 3) in aanmerking voor een noodbehandeling en kregen open brodalumab 210 mg elke 2 weken.
Resultaten – Week 12 (AMAGINE – 1)
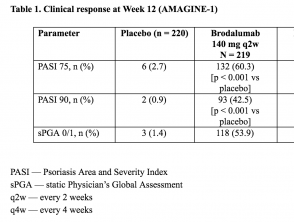
- In week 12 is de co–primair eindpunt van een reductie van 75% in de Psoriasis Area and Severity Index-score (PASI 75) werd bereikt bij 83% (95%-betrouwbaarheidsinterval [CI] 78-88), 60% (95%-BI: 54-67) en 3% (95%-BI: 1-6) van de patiënten gerandomiseerd naar brodalumab 210 mg elke 2 weken, brodalumab 140 mg elke 2 weken en placebo, respectievelijk.
- De overeenkomstige percentages voor sPGA-succes waren 76% (95% BI: 70-81), 54% (95% BI 47-61) en 1% (95% BI: 0-4) (p <0,001) para brodalumab 210 mg cada 2 semanas, brodalumab 140 mg cada 2 semanas y placebo, respectivamente.
- de mediaan- De tijd tot zowel PASI 75-respons als sPGA-succes was 4 en 6 weken bij patiënten die gerandomiseerd waren naar respectievelijk brodalumab 210 mg en 140 mg.
- Ziekenhuisangst en depressie Schaal scores werden geanalyseerd in week 12. Statistisch significante dalingen (p <0,001) en voor de helft Depressie werd waargenomen bij de doses brodalumab van 210 mg (5,5% tot 3,4%) en 140 mg (5,2% tot 3,5%). baseren in week 12. De placebogroep was onveranderd (5,3% bij aanvang en 5,5% in week 12).
Resultaten: ontwennings-/herbehandelingsfase (AMAGINE – 1)
- In week 52 waren de percentages patiënten met sPGA-succes 83% en 0% voor respectievelijk de groepen brodalumab 210 mg en placebo (p <0,001 frente a placebo).
- In week 52 waren de percentages patiënten met sPGA-succes 70% en 5% voor respectievelijk de geherrandomiseerde brodalumab 140 mg- en placebogroepen (p <0,001 frente a placebo).
- Patiënten bij wie de ziekte terugkeerde (sPGA ≥ 3 in week 16) tijdens de ontwenningsfase kwamen in aanmerking voor herbehandeling met hun inductiedosis brodalumab.
- Van deze patiënten bereikten 97% die brodalumab 210 mg kregen en 84% die brodalumab 140 mg kregen een sPGA-score van 0 of 1 na 12 weken herbehandeling.
- De mediane tijd om sPGA-succes te herwinnen voor zowel brodalumab 210 mg als 140 mg was 4 weken.
Tabel 1. Klinische respons in week 12 (AMAGINE – 1)
Tabel 1 – Klinische respons in week 12 (AMAGINE – 1)
Bijwerkingen – Week 12 (AMAGINE – 1)
De meest voorkomende bijwerkingen (≥ 5% in welke groep dan ook) in week 12 waren:
- Nasofaryngitis
- bovenste luchtwegen infectie
- Hoofdpijn.
Tabel 2. Vaak voorkomende bijwerkingen in week 12 (AMAGINE-1)
Tabel 2. Vaak voorkomende bijwerkingen in week 12 (AMAGINE-1)
Er waren vier fatale bijwerkingen tot en met week 52: deze omvatten:
- Plotselinge dood bij een patiënt die brodalumab 210 mg kreeg (inductie- en herbehandelings-/ontwenningsfase)
- Een opzettelijke overdosis illegale drugs die door de medische onderzoeker als zelfmoord wordt beschouwd bij een patiënt die placebo (inductiefase) en brodalumab 210 mg (ontwenningsfase) kreeg
- EEN slokdarm varices bloeding bij een patiënt met een voorgeschiedenis van cirrose die brodalumab 210 mg krijgen (inductie- en stopzettings-/herbehandelingsfase).
- EEN cerebrovasculair ongeval bij een patiënt die brodalumab 210 mg (inductiefase), placebo (ontwenningsfase) en brodalumab 210 mg (herbehandelingsfase) kreeg.
AMAGINE – 2 en AMAGINE – 3
- AMAGINE-2 en AMAGINE-3 waren twee grote, multinationale, dubbelblinde, actieve comparator-gecontroleerde fase 3-onderzoeken met parallelle groepen, die een 12 weken durende inductiefase en een 40 weken durende onderhoudsfase omvatten.
- Tijdens de 12 weken durende inductiefase werden patiënten gerandomiseerd met behulp van een verhouding van 2:2:1:1 om brodalumab 210 mg of 140 mg elke 2 weken te krijgen, ustekinumab (45 mg voor proefpersonen <100 kg de peso y 90 mg para sujetos> 100 kg) elke 4 weken of placebo.
Resultaten van de inductiefase – Week 12 (AMAGINE-2 en AMAGINE-3)
- De primaire doelstellingen waren het evalueren van de superioriteit van brodalumab ten opzichte van placebo in week 12 met betrekking tot de PASI 75-respons en een sPGA-score van 0 of 1 (heldere of bijna heldere huid), en de superioriteit van brodalumab ten opzichte van ustekinumab in week 12 met een reductie van 100% in PASI 100.
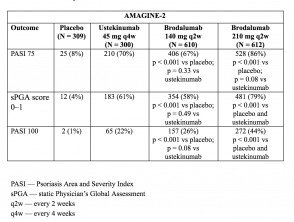
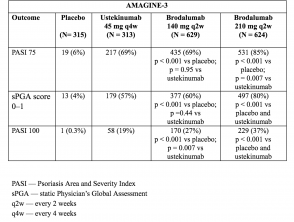
- In week 12 waren de PASI 75-responspercentages hoger met brodalumab 210 mg en 140 mg dan met placebo (respectievelijk 86% en 67%, versus respectievelijk 8% [AMAGINE-2] en 85% en 69%, respectievelijk versus 6% [AMAGINE-3];p <0,001).
- De mediane tijd tot PASI 75-respons was 4 weken voor brodalumab 210 mg versus ongeveer 2 maanden voor ustekinumab.
- De sPGA-scores van 0 of 1 waren ook hoger bij brodalumab 210 mg versus ustekinumab (p <0,001).
- PASI 100-responspercentages in week 12 waren significant hoger met brodalumab 210 mg dan met ustekinumab (44% versus 22% [AMAGINE–2] en 37% versus 19% [AMAGINE–3]; p <0,001).
Tabellen 3 en 4. Klinische respons in week 12 – AMAGINE-2 en AMAGINE-3
Tabel 3. Klinische respons in week 12 – AMAGINE-2
Tabel 4. Klinische respons in week 12 – AMAGINE-3
Resultaten onderhoudsfase: AMAGINE – 2 en AMAGINE – 3
- In week 12 ondergingen patiënten die oorspronkelijk waren gerandomiseerd naar brodalumab een herhaalde randomisatie, in een verhouding van 2:2:2:1, naar een van de vier onderhoudsregimes: brodalumab 210 mg elke 2 weken, 140 mg elke 2 weken, 140 mg elke 2 weken. 4 weken, of 140 mg elke 8 weken, gestratificeerd naar lichaamsgewicht in week 12 (≤ 100 kg of > 100 kg), inductieregime en respons in week 12 (sPGA-score, 0 of ≥1).
- Patiënten die oorspronkelijk waren gerandomiseerd om placebo te krijgen, werden overgezet op brodalumab 210 mg elke 2 weken en patiënten die oorspronkelijk waren gerandomiseerd om ustekinumab te krijgen, bleven elke 12 weken ustekinumab krijgen tot week 52.
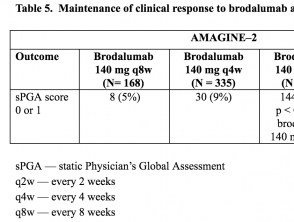
- In week 52 was het percentage patiënten met een sPGA-score van 0 of 1 significant hoger onder degenen die brodalumab 210 mg of 140 mg elke 2 weken kregen dan onder degenen die de andere brodalumab-onderhoudsregimes kregen (p <0,001).
- PASI-responscurven in de loop van de tijd voor patiënten die tijdens het onderzoek 210 mg brodalumab of gedurende het hele onderzoek ustekinumab kregen, lieten zien dat de responspercentages toenamen tot en met week 12 en stabiliseerden in de weken 16 tot en met 52.
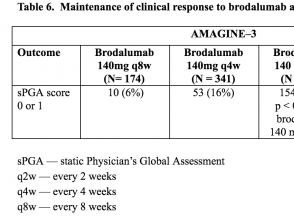
Tabellen 5 en 6. Behoud van de klinische respons op brodalumab in week 52 – AMAGINE-2 en AMAGINE-3
Tabel 5. Behoud van de klinische respons op brodalumab in week 52 – AMAGINE-2
Tabel 6. Behoud van de klinische respons op brodalumab in week 52 – AMAGINE-3
Bijwerkingen: AMAGINE – 2 en AMAGINE – 3
- In de inductiefase waren de meest voorkomende bijwerkingen nasofaryngitis, infectie van de bovenste luchtwegen, hoofdpijn en artralgie.
- Met uitzondering van infecties van de bovenste luchtwegen kwamen deze voorvallen vaker voor bij brodalumab dan bij placebo of ustekinumab in het AMAGINE-2-onderzoek.
- Artralgie kwam vaker voor bij brodalumab dan bij placebo of ustekinumab in het AMAGINE-3-onderzoek.
- Het aantal ernstige bijwerkingen per 100 patiëntjaren tot en met week 52 was 8,3 met brodalumab en 13,0 met ustekinumab in het AMAGINE-2-onderzoek en respectievelijk 7,9 en 4,0 in het AMAGINE-3-onderzoek.
- Er waren geen klinisch duidelijke verschillen in de soorten ernstige bijwerkingen tussen de onderzoeksgroepen.
- candida infecties kwam vaker voor bij brodalumab dan bij ustekinumab of placebo tijdens de inductiefase; alle infecties werden geclassificeerd als mild of matig en geen enkele was systemisch. Deze trend zette zich voort tot week 52.
- Het aantal ernstige infectieuze voorvallen per 100 patiëntjaren blootstelling aan brodalumab tot en met week 52 was 1,0 in het AMAGINE-2-onderzoek en 1,3 in het AMAGINE-3-onderzoek; de overeenkomstige percentages met ustekinumab waren 0,8 en 1,2.
Brodalumab – toekomstig potentieel
- De IL-17-cytokineroute speelt een belangrijke rol bij psoriasis.
- Drie fase 3-studies met brodalumab hebben de belangrijke rol van de IL-17-receptor bij matige tot ernstige psoriasis gevalideerd.
- Brodalumab bleek effectief te zijn hoger ten opzichte van placebo en ustekinumab met betrekking tot de PASI 100-respons in een vergelijking van brodalumab 210 mg elke 2 weken met ustekinumab.
- Behandeling met Brodalumab resulteerde in een snelle vermindering van de tekenen en symptomen van psoriasis.
- De mediane tijd tot een PASI 75-respons was 4 weken met brodalumab 210 mg elke 2 weken, ongeveer tweemaal zo snel als de mediane tijd tot een PASI 75-respons met ustekinumab.
- Alleen al op basis van de werkzaamheid zouden brodalumab en andere biologische geneesmiddelen uit de IL-17-klasse eerstelijnstherapie kunnen worden voor matige tot ernstige plaque psoriasis.
- Veiligheidsoverwegingen met betrekking tot depressie en suïcidaliteit zouden echter het gebruik van brodalumab kunnen belemmeren ten gunste van de andere IL-17 biologische geneesmiddelen, secukinumab en ixekizumab.
- Om een volledig inzicht te krijgen in het veiligheidsprofiel van brodalumab kunnen verdere klinische onderzoeken met grote aantallen patiënten en langere follow-upperioden noodzakelijk zijn.