Was ist Cobimetinib?
Cobimetinib ist ein verschreibungspflichtiges Arzneimittel zur Behandlung Melanom die sich auf andere Teile des Körpers ausgebreitet hat, nicht durch eine Operation entfernt werden kann und eine Anomalie aufweist BRAF Gen. Es sollte nicht zur Behandlung von Melanomen bei Patienten mit einem normalen oder Wildtyp angewendet werden. BRAF Gen.
2015 hat die US Food and Drug Administration (FDA) Cobimetinib (Cotellic™, Genentech Inc. Kalifornien, USA) in Kombination mit Vemurafenib (einer BRAF-spezifischen Kinase) zugelassen Inhibitor) zur Behandlung von Melanomen.
Im selben Jahr gab der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur eine positive Stellungnahme für die Marktzulassung von Cobimetinib in der Europäischen Union ab.
Cobimetinib hat seitdem die Marktzulassung in Neuseeland durch Medsafe im Jahr 2017 für die Behandlung von Melanompatienten erhalten.
Die FDA-Zulassung basierte auf den Ergebnissen der Phase-III-CoBRIM-Studie, die zeigte, dass Cobimetinib in Kombination mit Vemurafenib das Risiko einer Verschlechterung der Erkrankung oder des Todes bei Melanompatienten um etwa die Hälfte reduzierte.
Wichtige Hinweise aus klinischen Studien für Cobimetinib
Die CoBRIM-Studie
CoBRIM war ein internationales, zufällig, Doppelblind, Placebo-Kontrollierte Phase-III-Studie zur Bewertung der Sicherheit und Wirksamkeit Cobimetinib 60 mg einmal täglich plus Vemurafenib 960 mg zweimal täglich im Vergleich zu Vemurafenib 960 mg zweimal täglich plus Placebo. An der Studie nahmen insgesamt 495 Patienten teil, die alle zuvor nicht behandelt worden waren. BRAF V600 Mutation-positiv, nicht resezierbar, lokal fortgeschritten oder metastatisch Melanom.
Das Vorhandensein von BRAF Die V600-Mutation wurde mit dem cobas nachgewiesen®; 407 4800 BRAF V600-Mutationstest.
- Alle Patienten erhielten an den Tagen 1 bis 28 zweimal täglich 960 mg Vemurafenib oral.
- Die Patienten wurden randomisiert und erhielten an den Tagen 1 bis 21 jedes 28-Tage-Zyklus einmal täglich 60 mg Cobimetinib oder ein entsprechendes Placebo oral. Randomisierung stratifiziert nach geografischer Region (Nordamerika vs. Europa vs. Australien/Neuseeland/andere) und Krankheitsstadium (Stadium IIIc nicht resezierbar, M1a oder M1b vs. Stadium M1c).
- Die Behandlung wurde bis zum Fortschreiten der Krankheit fortgesetzt, nicht akzeptabel Toxizität, oder Widerruf der Einwilligung.
- Patienten, die auf Placebo randomisiert wurden, wurde Cobimetinib zum Zeitpunkt der Krankheitsprogression nicht angeboten.
- Der primäre Wirksamkeitsendpunkt war das vom Prüfarzt beurteilte progressionsfreie Überleben (PFS) gemäß RECIST v1.1.
- Zu den sekundären Endpunkten gehörten das von einem unabhängigen Prüfungsausschuss ermittelte PFS, die objektive Ansprechrate, das Gesamtüberleben und die Dauer des Ansprechens.
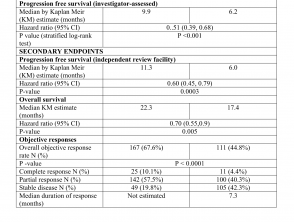
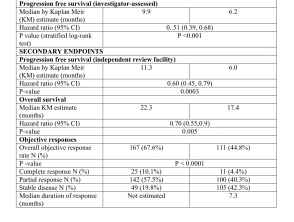
Die Wirksamkeitsergebnisse sind in Tabelle 1 zusammengefasst.
Wirksamkeitsergebnisse aus der CoBRIM-Studie
Wirksamkeitsergebnisse aus der CoBRIM-Studie
Nebenwirkungen – Erfahrung in klinischen Studien (CoBRIM-Studie)
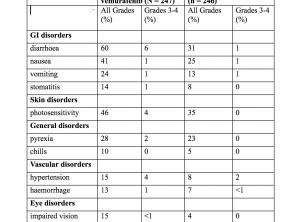
Am häufigsten (≥ 20%) Nebenwirkungen mit Cobimetinib waren:
- Durchfall
- Lichtempfindlichkeit Reaktion
- Übelkeit
- Pyrexie
- Erbrechen
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, Nebenwirkung Die in klinischen Studien beobachteten Raten spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.. In der CoBRIM-Studie trat bei 15% bei Patienten, die Cobimetinib erhielten, eine Nebenwirkung auf, die zu einem dauerhaften Absetzen des Medikaments führte.
Die häufigsten Nebenwirkungen, die zum dauerhaften Absetzen des Medikaments führten, waren:
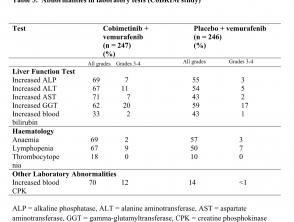
- Leber Labor Anomalien, definiert als erhöht Aspartat-Aminotransferase (2.4%), erhöhte Gamma-Glutamyltransferase (1.6%) und erhöht Alanin-Aminotransferase (ALT; 1,6%)
- Eruption (1,6%)
- Fieber (1.2%)
- Netzhautablösung (2%).
Bei den 247 Patienten, die Cobimetinib erhielten, führten Nebenwirkungen bei einem 55% zu Dosisunterbrechungen oder -reduktionen. Die häufigsten Gründe für Unterbrechungen oder Reduzierungen der Cobimetinib-Dosis waren:
- Hautausschlag (11%)
- Durchfall (9%)
- Chorioretinopathie – Flüssigkeitsansammlung unter der Netzhaut (7%)
- Fieber (6%)
- Erbrechen (6%)
- Übelkeit (5%)
- Erhöhte Kreatinphosphokinase (4.9%).
Häufigkeit unerwünschter Ereignisse bei >10%-Patienten (CoBRIM-Studie)
Nebenwirkungen (CoBRIM-Studie)
Auffälligkeiten bei Labortests (CoBRIM-Studie)
Auffälligkeiten bei Labortests (CoBRIM-Studie)
Meldung vermuteter Nebenwirkungen
Die Meldung vermuteter Nebenwirkungen nach der Zulassung eines Arzneimittels ist wichtig, da sie eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels ermöglicht. Angehörigen der Gesundheitsberufe in Neuseeland wird empfohlen, jeden Verdachtsfall einer Nebenwirkung zu melden das neuseeländische Pharmakovigilanzzentrum.
Überdosis
Es liegen keine Erfahrungen mit einer Cobimetinib-Überdosierung in klinischen Studien am Menschen vor. Im Falle einer vermuteten Überdosierung sollte Cobimetinib abgesetzt und eine unterstützende Behandlung eingeleitet werden. Es gibt kein spezifisches Antidot für eine Cobimetinib-Überdosierung.
Das New Zealand National Poisons Centre sollte unter 0800 764 766 kontaktiert werden, um Ratschläge zum Umgang mit einer Überdosierung zu erhalten.
Cobimetinib: Zukunftspotenzial
- Neue Behandlungen für metastasierendes Melanom wirken durch verschiedene Mechanismen, um die Immunantwort zu verstärken und zu blockieren Mobiltelefon Proliferation.
- Cobimetinib ist wie Trametinib ein MEK Inhibitor. MEK1 und MEK2 sind Tyrosinkinasen die mit BRAF interagieren und zu einem unkontrollierten Wachstum von Melanomzellen führen.
- Klinische Studien haben gezeigt, dass die Zugabe von Cobimetinib zu Vemurafenib das Überleben von Melanompatienten mit der V600 BRAF-Mutation verbessert.
- Das Gesamtüberleben bei Patienten, die mit Nivolumab und Pembrolizumab behandelt wurden, scheint zu sein höher verglichen mit dem, was mit Cobimetinib und Vemurafenib erreicht wurde.
- Das Gesamtüberleben bei Patienten, die mit einer Kombination aus Vemurafenib und Cobimetinib behandelt wurden, scheint jedoch ähnlich zu sein wie bei anderen verfügbaren Behandlungsstrategien für die Behandlung von inoperablen Metastasen. der Böse Melanom wie Kombinationen von Nivolumab und Ipilimumab und Dabrafenib mit Trametinib.
- Für PFS schien Dabrafenib in Kombination mit Trametinib und Vemurafenib in Kombination mit Cobimetinib eine höhere Wahrscheinlichkeit für eine gute Leistung zu haben als andere verfügbare Behandlungsstrategien.
- Bei schwerwiegenden unerwünschten Ereignissen schienen Pembrolizumab und Nivolumab eine höhere Wahrscheinlichkeit für weniger schwerwiegende unerwünschte Ereignisse aufzuweisen als Cobimetinib und Vemurafenib.
- Keine dieser Interventionen ist jedoch bei maximalen Einzelhandelspreisen in Apotheken kosteneffektiv, und die Auswirkungen auf das Budget auf die klinische Praxis können erheblich sein.
- Der Schnelle Tumor Reaktion auf BRAF/MEK Hemmung ist oft kurzlebig wie Tumore entwickeln Resistenz gegen eine Kombinationstherapie.
- Neue Studien beginnen, um die Zugabe eines dritten zielgerichteten Wirkstoffs oder einer Immuntherapie zu untersuchen, um die Dauerhaftigkeit des Ansprechens auf die Behandlung zu erhöhen.