Cos'è cobimetinib?
Cobimetinib è un medicinale da prescrizione usato per il trattamento melanoma che si è diffuso ad altre parti del corpo, non può essere rimosso chirurgicamente e presenta un'anomalia BRAF gene. Non dovrebbe essere usato per trattare il melanoma in pazienti con un tipo normale o selvaggio. BRAF gene.
Nel 2015, la Food and Drug Administration (FDA) statunitense ha approvato cobimetinib (Cotellic ™, Genentech Inc. California, USA) in combinazione con vemurafenib (una BRAF-chinasi specifica inibitore) per il trattamento del melanoma.
Nello stesso anno, il comitato per i medicinali per uso umano dell'Agenzia europea per i medicinali ha emesso un parere positivo per l'autorizzazione all'immissione in commercio di cobimetinib nell'Unione europea.
Cobimetinib è stato da allora approvato per la commercializzazione in Nuova Zelanda attraverso Medsafe nel 2017 per il trattamento dei pazienti affetti da melanoma.
L'approvazione della FDA si è basata sui risultati dello studio di fase III CoBRIM, che ha dimostrato che cobimetinib, quando usato in combinazione con vemurafenib, riduce il rischio di peggioramento della malattia o di morte di circa la metà nei pazienti con melanoma.
Evidenze chiave dagli studi clinici per cobimetinib
Lo studio CoBRIM
CoBRIM era un internazionale, randomizzato, doppio cieco, placebo-Studio di Fase III controllato che ha valutato la sicurezza e efficacia cobimetinib 60 mg una volta al giorno più vemurafenib 960 mg due volte al giorno rispetto a vemurafenib 960 mg due volte al giorno più placebo. Un totale di 495 pazienti hanno partecipato allo studio, tutti non trattati in precedenza. BRAF V600 mutazione-positivo, non resecabile, localmente avanzato o metastatico melanoma.
La presenza di BRAF La mutazione V600 è stata rilevata utilizzando cobas®; 407 4800 BRAF Test di mutazione V600.
- Tutti i pazienti hanno ricevuto vemurafenib 960 mg per via orale due volte al giorno nei giorni da 1 a 28.
- I pazienti sono stati randomizzati a ricevere cobimetinib 60 mg o un equivalente placebo per via orale una volta al giorno nei giorni da 1 a 21 di ciascun ciclo di 28 giorni. Randomizzazione È stato stratificato per regione geografica (Nord America vs Europa vs Australia / Nuova Zelanda / altri) e stadio della malattia (stadio IIIc non resecabile, M1a o M1b vs stadio M1c).
- Il trattamento è stato continuato fino alla progressione della malattia, inaccettabile tossicitào revoca del consenso.
- Ai pazienti randomizzati al placebo non è stato offerto cobimetinib al momento della progressione della malattia.
- L'outcome primario di efficacia era la sopravvivenza libera da progressione (PFS) valutata dallo sperimentatore secondo RECIST v1.1.
- Gli endpoint secondari includevano la PFS da parte di un comitato di revisione indipendente, il tasso di risposta obiettiva, la sopravvivenza globale e la durata della risposta.
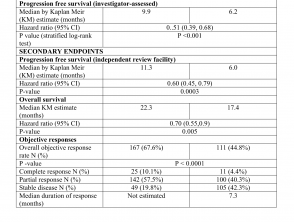
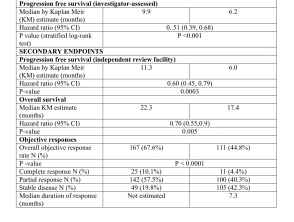
I risultati di efficacia sono riassunti nella Tabella 1.
Risultati di efficacia dello studio CoBRIM
Risultati di efficacia dello studio CoBRIM
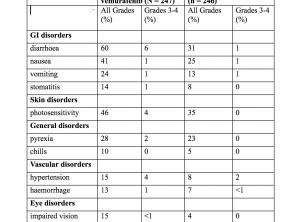
Eventi avversi - esperienza in studi clinici (studio CoBRIM)
Il più comune (≥ 20%) Reazioni avverse con cobimetinib sono stati:
- Diarrea
- Fotosensibilità reazione
- Nausea
- Piressia
- Vomito
Poiché gli studi clinici sono condotti in condizioni molto diverse, reazione avversa I tassi osservati negli studi clinici potrebbero non riflettere i tassi visti nella pratica.. Nello studio CoBRIM, 15% di pazienti che ricevevano cobimetinib ha manifestato una reazione avversa che ha portato alla sospensione permanente del farmaco.
Le reazioni avverse più comuni che hanno portato alla sospensione permanente del farmaco sono state:
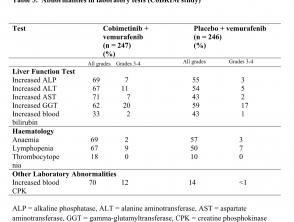
- Laboratorio del fegato anomalie, definito come aumentato aspartato aminotransferasi (2.4%), aumento della gamma glutamiltransferasi (1.6%) e aumento alanina aminotransferasi (ALT; 1,6%)
- Eruzione (1,6%)
- Piressia (1.2%)
- Distacco di retina (2%).
Tra i 247 pazienti che hanno ricevuto cobimetinib, le reazioni avverse hanno comportato interruzioni o riduzioni della dose di 55%. Le ragioni più comuni per le riduzioni o le interruzioni della dose di cobimetinib sono state:
- Eruzione cutanea (11%)
- Diarrea (9%)
- Corioretinopatia Accumulo di liquido sotto la retina (7%)
- Piressia (6%)
- Vomito (6%)
- Nausea (5%)
- Creatinfosfochinasi aumentata (4.9%).
Incidenza di eventi avversi nei pazienti> 10% (studio CoBRIM)
Eventi avversi (studio CoBRIM)
Anomalie nei test di laboratorio (studio CoBRIM)
Anomalie nei test di laboratorio (studio CoBRIM)
Segnalazione di sospette reazioni avverse
La segnalazione di sospette reazioni avverse dopo l'autorizzazione di un medicinale è importante in quanto consente il monitoraggio continuo del rapporto rischio / beneficio del medicinale. Si consiglia agli operatori sanitari neozelandesi di segnalare qualsiasi reazione avversa sospetta a il Centro di farmacovigilanza della Nuova Zelanda.
Overdose
Non c'è esperienza con il sovradosaggio di cobimetinib negli studi clinici sull'uomo. In caso di sospetto sovradosaggio, cobimetinib deve essere interrotto e deve essere istituita una terapia di supporto. Non esiste un antidoto specifico per il sovradosaggio di cobimetinib.
Il New Zealand National Poisons Centre deve essere contattato al numero 0800 764 766 per consigli sulla gestione del sovradosaggio.
Cobimetinib: potenziale futuro
- Nuovi trattamenti per il melanoma metastatico funzionano attraverso diversi meccanismi per migliorare la risposta immunitaria e il blocco cellulare proliferazione.
- Come trametinib, cobimetinib è un MEK inibitore. MEK1 e MEK2 lo sono tirosin chinasi che interagiscono con BRAF e portano alla crescita incontrollata delle cellule di melanoma.
- Studi clinici hanno dimostrato che l'aggiunta di cobimetinib a vemurafenib migliora la sopravvivenza nei pazienti con melanoma che ospitano la mutazione V600 BRAF.
- La sopravvivenza globale nei pazienti trattati con nivolumab e pembrolizumab sembra essere più alto rispetto a quanto ottenuto con cobimetinib e vemurafenib.
- Tuttavia, la sopravvivenza globale nei pazienti trattati con una combinazione di vemurafenib e cobimetinib sembra essere simile ad altre strategie di trattamento disponibili per il trattamento delle metastasi non resecabili. il malvagio melanoma come combinazioni di nivolumab e ipilimumab e dabrafenib con trametinib.
- Per la PFS, dabrafenib in combinazione con trametinib e vemurafenib in combinazione con cobimetinib sembra avere una maggiore probabilità di buone prestazioni rispetto ad altre strategie di trattamento disponibili.
- Per gli eventi avversi gravi, pembrolizumab e nivolumab sembravano avere una maggiore probabilità di un minor numero di eventi avversi gravi rispetto a cobimetinib e vemurafenib.
- Tuttavia, nessuno di questi interventi è efficace in termini di costi ai prezzi massimi di vendita al dettaglio in farmacia e gli impatti di bilancio sulla pratica clinica possono essere sostanziali.
- La velocità tumore risposta a BRAF / MEK inibizione spesso di breve durata come i tumori sviluppare resistenza alla terapia di combinazione.
- Nuovi studi stanno iniziando a indagare sull'aggiunta di un terzo agente mirato o immunoterapia per aumentare la durata della risposta al trattamento.