Einführung
Secukinumab gehört zur Klasse der biologischen Behandlungen, die als bekannt sind monoklonal Antikörper. Der Markenname von Secukinumab ist Cosentyx® (Novartis AG) [1].
Secukinumab ist für die Behandlung mittelschwerer bis schwerer Fälle zugelassen. Nummernschild Psoriasis bei erwachsenen Patienten, die dafür in Frage kommen systemisch Therapie (ein Medikament, das in den Blutkreislauf aufgenommen und in allen Teilen des Körpers verteilt wird, zum Beispiel Methotrexat, Acitretin oder Ciclosporin) oder Phototherapie (Lichttherapie). Es ist auch für die Behandlung von Psoriasis-Patienten zugelassen. Arthritis und Morbus Bechterew [1].
Secukinumab wurde im Januar 2015 von der US-amerikanischen Food and Drug Administration (FDA) zugelassen und der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur empfahl die Marktzulassung für Secukinumab.
In Neuseeland wurde Secukinumab im August 2015 als verschreibungspflichtiges Medikament eingestuft. Secukinumab wird in Neuseeland als Erst- und Zweitlinienbehandlung für schwere Fälle finanziert. chronisch Plaque-Psoriasis im Antrag auf Sonderzulassung seit Oktober 2018 [2].
Wie wirkt Secukinumab?
Interleukin-17A (IL-17A) ist ein Eckpfeiler Zytokin (Paketzusteller Protein) beteiligt an Entwicklung der Psoriasis und kommt bei Psoriasis in hohen Konzentrationen vor Platten [3]. Siehe Interleukin-17 in entzündlich Hautkrankheiten.
Secukinumab ist ein humanes monoklonales IgG1 Antikörper das selektiv an IL-17A bindet und dessen entzündungsfördernde Wirkung schnell hemmt [3,4].
Wie wirksam ist Secukinumab bei Psoriasis?
Zahlreiche Daten belegen die Wirksamkeit von Secukinumab bei der Reduzierung der Krankheitsaktivität (PASI Score) bei Patienten mit Psoriasis, mit schnellem Wirkungseintritt und einem günstigen Sicherheitsprofil [1, 5–8].
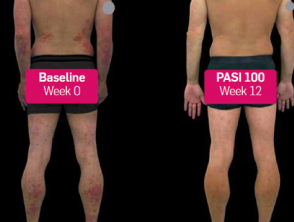
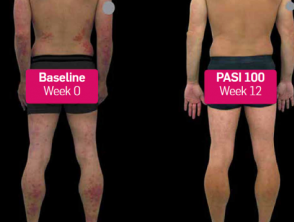
Secukinumab wirkt nachweislich schnell und lindert Psoriasis-Symptome wirksam. [5–7]. Die ERASURE-Studie (N = 738) berichtete über eine Reduzierung von 50% in halb PASI-Score aus Woche 3 [5]. Die CLEAR-Studie (N = 676) zeigte, dass 5/10 Patienten in Woche 4 eine Verringerung des PASI-Scores um 75% erreichten, was sich auf 8/10 Patienten erhöhte, die nach 16-wöchiger Behandlung eine Verringerung des Schweregrads und Ausmaßes ihrer Psoriasis um 90% erreichten. [6, 7].
das Wirksamkeit von Secukinumab bleibt auch langfristig erhalten: In der SCULPTURE-Verlängerungsstudie (N = 168) behielten mehr als 9/10 Patienten ihr PASI-Ansprechen bis zu 5 Jahre lang bei [8].
Psoriasis vor und 3 Monate nach Beginn der Behandlung mit Secukinumab
Vor und nach Secukinumab
Wie gut wird Secukinumab bei Psoriasis vertragen?
Secukinumab hat ein gut verträgliches Sicherheitsprofil mit geringer Immunogenität. [1].
Bei weniger als 1%-Patienten treten Reaktionen an der Injektionsstelle auf. In klinischen Studien am häufigsten Nebenwirkungen (>2%) stammten aus den oberen Atemwegen Infektionen (Häufiger Nasopharyngitis (11.4%) und Rhinitis (2,5%)) und Durchfall (4,1%). Die meisten Ereignisse waren von leichter bis mittelschwerer Schwere. [1].
Wenn bei Ihnen eines der folgenden Anzeichen oder Symptome auftritt, sollten Sie sich an Ihren Arzt wenden. [9].
- Fieber, grippeähnliche Symptome, Nachtschweiß
- Fühlen Sie sich müde oder kurzatmig. ein Husten, der nicht verschwindet
- Heiße, rote, schmerzhafte oder wunde Haut Eruption mit Blasen
- Brennen beim Wasserlassen
- Schwierigkeiten beim Atmen oder Schlucken
- Niedriger Blutdruck, der Schwindel oder Benommenheit verursachen kann.
- Schwellung von Gesicht, Lippen, Mund oder Rachen.
- Stark juckende Haut mit rotem Ausschlag oder erhabenen Beulen
Secukinumab hat ein etabliertes Sicherheitsprofil; Bei Patienten, die in der SCULPTURE-Verlängerungsstudie bis zu 5 Jahre lang mit Secukinumab behandelt wurden, wurden keine neuen Sicherheitssignale beobachtet [8].
Secukinumab hat ein Sicherheitsprofil gezeigt, das mit dem von Ustekinumab und Etanercept vergleichbar ist. [5, 6].
Erfahren Sie mehr über wichtige Erkenntnisse aus klinischen Studien mit Secukinumab.
Wie wird Secukinumab verabreicht?
Secukinumab wird verabreicht von subkutan Injektion. Die übliche Dosis bei Psoriasis beträgt 300 mg in den Wochen 0, 1, 2, 3 und 4, gefolgt von 300 mg alle 4 Wochen. Jede 300-mg-Dosis wird in zwei 150-mg-Injektionen verabreicht. [1].
Nach der ersten Beratung und Schulung durch medizinisches Fachpersonal können sich Patienten Secukinumab mit einem vorbereiteten SensoReady-Pen selbst in den Oberschenkel oder Bauch verabreichen oder ihre Pflegekraft in die Oberarme verabreichen. Jeder SensoReady-Stift enthält eine 150-mg-Dosis Secukinumab. Für jede Injektionsreihe sollte eine andere Stelle verwendet werden, um Schmerzen zu lindern und zu verhindern, dass die Haut empfindlich, rot, gequetscht oder hart wird. [1].
Secukinumab sollte bis kurz vor der Injektion im Kühlschrank bei 2–8 °C aufbewahrt werden. [1].
Secukinumab kann allein oder bei Bedarf in Kombination mit Methotrexat verabreicht werden. [1].
Vorsichtsmaßnahmen für Patienten, die Secukinumab einnehmen
Secukinumab kann das Infektionsrisiko erhöhen. Daher ist Vorsicht geboten, wenn die Anwendung von Secukinumab bei Patienten mit chronischen Erkrankungen in Betracht gezogen wird. Infektion, oder eine Geschichte von wiederkehrend Infektion [1].
In klinischen Psoriasis-Studien waren die meisten Infektionen, die bei Patienten unter Secukinumab beobachtet wurden, leicht oder mittelschwer. nicht ernsthaft Candida Infektionen wurden bei mit Secukinumab (1,2%) behandelten Patienten häufiger gemeldet als bei Patienten, die mit Secukinumab (1,2%) behandelt wurden Placebo (0,3%) [1].
Patienten sollten angewiesen werden, ärztlichen Rat einzuholen, wenn Anzeichen oder Symptome auftreten, die auf eine Infektion hinweisen. Wenn bei einem Patienten eine schwere Infektion auftritt, sollte der Patient engmaschig überwacht werden und Secukinumab sollte nicht verabreicht werden, bis die Infektion abgeklungen ist. [1].
Secukinumab ist nicht mit einem Anstieg verbunden Anfälligkeit zu Tuberkulose (TB). Patienten sollten vor Beginn der Behandlung mit Secukinumab auf Tuberkulose untersucht werden, und Secukinumab sollte Patienten mit aktiver Tuberkulose nicht verabreicht werden. [1].
Bei der Verschreibung von Secukinumab an Patienten mit aktivem Morbus Crohn ist Vorsicht geboten Exazerbationen Sie wurden in klinischen Studien mit Secukinumab beobachtet. Patienten mit aktivem Morbus Crohn sollten während der Behandlung mit Secukinumab engmaschig überwacht werden. [1].
Ja Anaphylaxie oder andere ernste allergische Reaktion Tritt eine solche Erkrankung auf, sollte Secukinumab sofort abgesetzt und eine geeignete Therapie eingeleitet werden. Der SensoReady-Stift verfügt über einen Latex-Gummistopfen. Obwohl in der Kappe kein Naturkautschuklatex nachgewiesen wurde, wurde die sichere Verwendung des SensoReady-Stifts bei Personen, die empfindlich auf Latex reagieren, nicht untersucht. [1].
Mit Secukinumab behandelte Patienten sollten während der Behandlung keine Lebendimpfstoffe erhalten. [1].
Therapeutisch Bei Patienten, die mit behandelt werden, sollte eine Überwachung in Betracht gezogen werden begleitend CYP450 Substrate mit einem engen therapeutischen Index [1].
Einsatz von Secukinumab bei speziellen Patientengruppen
Bei älteren Patienten (≥ 65 Jahre) ist keine Dosisanpassung erforderlich. In Pharmakokinetik Studien zufolge war die Clearance von Secukinumab bei älteren und älteren Menschen ähnlich <65 años [1].
Secukinumab wurde nicht speziell bei Patienten mit untersucht Nieren- oder hepatisch Verschlechterung, daher können keine Dosierungsempfehlungen gegeben werden [1].
Die Sicherheit und Wirksamkeit von Secukinumab bei pädiatrisch Patienten unter 18 Jahren ist bisher nicht geklärt [1].
Anwendung von Secukinumab in der Schwangerschaft (Kategorie C)
Für die Anwendung von Secukinumab bei Schwangeren liegen keine ausreichenden Daten vor. [1].
Entwicklung Toxizität Studien an Affen ergaben keine Hinweise auf eine Schädigung des Fötus durch Secukinumab. [1].
Secukinumab sollte während der Schwangerschaft nur dann angewendet werden, wenn der Nutzen die potenziellen Risiken deutlich überwiegt [1].
Wenn Secukinumab während der Schwangerschaft angewendet wurde, wird die Verabreichung von Lebendimpfstoffen an Neugeborene/Säuglinge in der Regel 16 Wochen nach der letzten Secukinumab-Dosis der Mutter nicht empfohlen. [1].
Bei stillenden Frauen ist Vorsicht geboten, da nicht bekannt ist, ob Secukinumab oder Secukinumab verabreicht wird Metaboliten Sie kommen in der Muttermilch vor [1].
Nachsorge während der Behandlung mit Secukinumab
Es wird empfohlen, dass Patienten, die biologische Medikamente einnehmen, etwa alle sechs Monate routinemäßige Blutuntersuchungen durchführen lassen, einschließlich eines großen Blutbildes und Leberfunktionstests.