introduzione
Secukinumab appartiene alla classe delle terapie biologiche note come monoclonale anticorpi. Il nome commerciale di secukinumab è Cosentyx.® (Novartis AG) [1].
Secukinumab è autorizzato per il trattamento della malattia da moderata a grave. targa psoriasi in pazienti adulti che sono candidati per sistemico terapia (un farmaco che viene assorbito nel flusso sanguigno e distribuito a tutte le parti del corpo, ad esempio metotrexato, acitretina o ciclosporina) o fototerapia (terapia della luce). È anche approvato per il trattamento della psoriasi. artrite e spondilite anchilosante [1].
Secukinumab è stato approvato dalla Food and Drug Administration (FDA) statunitense nel gennaio 2015 e il Committee for Medicinal Products for Human Use (CHMP) dell'Agenzia europea per i medicinali ha raccomandato l'autorizzazione all'immissione in commercio per secukinumab.
In Nuova Zelanda, secukinumab è stato classificato come farmaco da prescrizione nell'agosto 2015. Secukinumab è stato finanziato in Nuova Zelanda come trattamento di prima e seconda linea per i casi gravi cronica psoriasi a placche su richiesta di un'autorità speciale da ottobre 2018 [2].
Come funziona secukinumab?
Interleuchina-17A (IL-17A) è una pietra miliare citochina (Corriere di consegna proteina) coinvolti nella sviluppo di psoriasi e si trova in alte concentrazioni nella psoriasi piatti [3]. Vedi interleuchina-17 a infiammatorio disturbi della pelle.
Secukinumab è una IgG1 umana monoclonale anticorpo che si lega selettivamente a IL-17A, inibendo rapidamente i suoi effetti proinfiammatori [3,4].
Quanto è efficace secukinumab nella psoriasi?
Un ampio corpus di dati supporta l'efficacia di secukinumab nel ridurre l'attività della malattia (PASI punteggio) in pazienti con psoriasi, con un rapido inizio d'azione e un profilo di sicurezza favorevole [1, 5–8].
Secukinumab ha dimostrato di agire rapidamente per alleviare efficacemente i sintomi della psoriasi. [5–7]. Lo studio ERASURE (N = 738) ha riportato una riduzione di 50% in metà Punteggio PASI della settimana 3 [5]. Lo studio CLEAR (N = 676) ha mostrato che 5/10 pazienti hanno ottenuto una riduzione di 75% nel punteggio PASI alla settimana 4, che è aumentata a 8/10 pazienti che hanno ottenuto una riduzione di 90% della gravità e dell'estensione della psoriasi dopo 16 settimane di trattamento. . [6, 7].
il efficacia Secukinumab viene mantenuto anche a lungo termine: più di 9/10 pazienti hanno mantenuto la loro risposta PASI fino a 5 anni nello studio di estensione SCULPTURE (N = 168) [8].
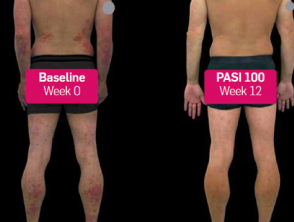
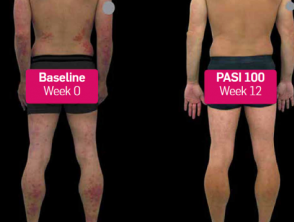
Psoriasi prima e 3 mesi dopo l'inizio di secukinumab
Prima e dopo secukinumab
Quanto è tollerato secukinumab nella psoriasi?
Secukinumab ha un profilo di sicurezza ben tollerato, con una bassa immunogenicità riportata. [1].
Meno di 1% di pazienti manifestano reazioni nel sito di iniezione. Negli studi clinici, il più comune eventi avversi (> 2%) provenivano dal tratto respiratorio superiore infezioni (Più frequentemente rinofaringite (11.4%) e rinite (2.5%)) e diarrea (4.1%). La maggior parte degli eventi era di gravità lieve o moderata. [1].
Se si verifica uno dei seguenti segni o sintomi, è necessario contattare il medico. [9].
- Febbre, sintomi simil-influenzali, sudorazione notturna
- Sensazione di stanchezza o mancanza di respiro. una tosse che non va via
- Pelle calda, arrossata, dolorante o dolorante eruzione con vesciche
- Bruciore durante la minzione
- Difficoltà a respirare o a deglutire
- Bassa pressione sanguigna, che può causare vertigini o stordimento.
- Gonfiore del viso, delle labbra, della bocca o della gola.
- Forte prurito della pelle, con un'eruzione cutanea rossa o protuberanze in rilievo
Secukinumab ha un profilo di sicurezza consolidato; non sono stati osservati nuovi segnali di sicurezza nei pazienti trattati con secukinumab fino a 5 anni nello studio di estensione SCULPTURE [8].
Secukinumab ha dimostrato un profilo di sicurezza paragonabile a quello di ustekinumab ed etanercept. [5, 6].
Ulteriori informazioni sulle prove chiave degli studi clinici su secukinumab.
Come viene somministrato secukinumab?
Secukinumab è somministrato da sottocutaneo iniezione. La dose abituale per la psoriasi è di 300 mg alle settimane 0, 1, 2, 3 e 4, seguita da 300 mg ogni 4 settimane. Ogni dose da 300 mg viene somministrata in due iniezioni da 150 mg. [1].
Dopo il consiglio iniziale e la formazione di un operatore sanitario, i pazienti possono autosomministrarsi secukinumab sulla coscia o sull'addome utilizzando una penna SensoReady pre-preparata o sulla parte superiore delle braccia del loro caregiver. Ogni penna SensoReady contiene una dose di 150 mg di secukinumab. Deve essere utilizzato un sito diverso per ciascuna serie di iniezioni per ridurre il dolore e prevenire che la pelle diventi tenera, arrossata, contusa o dura. [1].
Secukinumab deve essere conservato in frigorifero a 2-8°C fino a poco prima dell'iniezione. [1].
Secukinumab può essere somministrato da solo o, se necessario, in combinazione con metotrexato. [1].
Precauzioni necessarie per i pazienti che assumono secukinumab
Secukinumab ha il potenziale per aumentare il rischio di infezioni, pertanto occorre prestare attenzione quando si considera l'uso di secukinumab in pazienti con malattie croniche. infezione, o una storia di ricorrente infezione [1].
Negli studi clinici sulla psoriasi, la maggior parte delle infezioni osservate nei pazienti in trattamento con secukinumab era di intensità lieve o moderata. non serio Candida Le infezioni sono state riportate più frequentemente nei pazienti trattati con secukinumab (1,2%) rispetto a placebo (0,3%) [1].
I pazienti devono essere informati di consultare un medico se si verificano segni o sintomi indicativi di infezione. Se un paziente sviluppa un'infezione grave, il paziente deve essere attentamente monitorato e secukinumab non deve essere somministrato fino alla risoluzione dell'infezione. [1].
Secukinumab non è associato ad un aumento suscettibilità alla tubercolosi (TB). I pazienti devono essere sottoposti a screening per la tubercolosi prima di iniziare il trattamento con secukinumab e secukinumab non deve essere somministrato a pazienti con tubercolosi attiva. [1].
Deve essere prestata cautela quando si prescrive secukinumab a pazienti con malattia di Crohn attiva, poiché esso esacerbazioni Sono stati osservati negli studi clinici con secukinumab. I pazienti con malattia di Crohn in fase attiva devono essere attentamente monitorati durante la terapia con secukinumab. [1].
sì anafilassi o altro grave reazione allergica si verifica, secukinumab deve essere interrotto immediatamente e deve essere iniziata una terapia appropriata. La penna SensoReady ha un tappo in gomma di lattice. Sebbene nel cappuccio non venga rilevato lattice di gomma naturale, non è stato studiato l'uso sicuro della penna SensoReady nelle persone sensibili al lattice. [1].
I pazienti trattati con secukinumab non devono ricevere vaccini vivi durante il trattamento. [1].
Terapeutico Il monitoraggio deve essere preso in considerazione nei pazienti in trattamento con concomitante CYP450 substrati con uno stretto indice terapeutico [1].
Uso di secukinumab in gruppi speciali di pazienti
Non è necessario alcun aggiustamento della dose nei pazienti anziani (≥ 65 anni). In farmacocinetica studi, la clearance di secukinumab è risultata simile tra i pazienti anziani e quelli non anziani. <65 años [1].
Secukinumab non è stato studiato in modo specifico nei pazienti con renale o epatica deterioramento, quindi non è possibile formulare raccomandazioni sulla dose [1].
La sicurezza e l'efficacia di secukinumab in pediatrico pazienti di età inferiore a 18 anni non è stato ancora stabilito [1].
Uso di secukinumab in gravidanza (categoria C)
Non ci sono dati sufficienti per l'uso di secukinumab nelle donne in gravidanza. [1].
Sviluppo tossicità Gli studi sulle scimmie non hanno trovato prove di danni al feto a causa di secukinumab. [1].
Secukinumab deve essere utilizzato durante la gravidanza solo se i benefici superano chiaramente i potenziali rischi [1].
Se secukinumab è stato utilizzato durante la gravidanza, la somministrazione di vaccini vivi a neonati/lattanti per 16 settimane dopo l'ultima dose di secukinumab della madre non è generalmente raccomandata. [1].
Si deve usare cautela nelle donne che allattano al seno, poiché non è noto se secukinumab o suoi metaboliti sono presenti nel latte materno [1].
Follow-up durante il trattamento con secukinumab
Si raccomanda ai pazienti che assumono farmaci biologici di sottoporsi a esami del sangue di routine ogni 6 mesi circa, inclusi emocromo completo e test di funzionalità epatica.