Invoering
Secukinumab behoort tot de klasse van biologische behandelingen die bekend staat als monoklonaal antistoffen. De merknaam van secukinumab is Cosentyx® (Novartis AG) [1].
Secukinumab is goedgekeurd voor de behandeling van matige tot ernstige gevallen. nummerplaat psoriasis bij volwassen patiënten die in aanmerking komen voor systemisch therapie (een geneesmiddel dat in de bloedbaan wordt opgenomen en naar alle delen van het lichaam wordt gedistribueerd, bijvoorbeeld methotrexaat, acitretine of cyclosporine) of fototherapie (fototherapie). Het is ook goedgekeurd voor de behandeling van psoriatische patiënten. artritis en spondylitis ankylopoetica [1].
Secukinumab werd in januari 2015 goedgekeurd door de Amerikaanse Food and Drug Administration (FDA), en het Comité voor geneesmiddelen voor menselijk gebruik (CHMP) van het Europees Geneesmiddelenbureau adviseerde een vergunning voor het in de handel brengen van secukinumab.
In Nieuw-Zeeland werd secukinumab in augustus 2015 geclassificeerd als een receptgeneesmiddel. Secukinumab is in Nieuw-Zeeland gefinancierd als eerste- en tweedelijnsbehandeling voor ernstige gevallen chronisch Plaque psoriasis in aanvraag voor bijzondere machtiging sinds oktober 2018 [2].
Hoe werkt secukinumab?
interleukine-17A (IL-17A) is een hoeksteen cytokine (Bezorgkoerier) eiwit) Betrokken in de ontwikkelen van psoriasis en wordt in hoge concentraties aangetroffen bij psoriasis platen [3]. Zie interleukine-17 in opruiend huidaandoeningen.
Secukinumab is een humaan IgG1-monoklonaal antilichaam dat selectief bindt aan IL-17A, waardoor de pro-inflammatoire effecten ervan snel worden geremd [3,4].
Hoe effectief is secukinumab bij psoriasis?
Een grote hoeveelheid gegevens ondersteunt de effectiviteit van secukinumab bij het verminderen van de ziekteactiviteit (PASI score) bij patiënten met psoriasis, met een snel intredend effect en een gunstig veiligheidsprofiel [1, 5-8].
Van secukinumab is aangetoond dat het snel werkt en de symptomen van psoriasis effectief verlicht. [5–7]. Het ERASURE-onderzoek (N = 738) rapporteerde een vermindering van 50% in voor de helft PASI-score vanaf week 3 [5]. Uit het CLEAR-onderzoek (N = 676) bleek dat 5/10 patiënten een 75%-reductie in de PASI-score bereikten in week 4, wat toenam tot 8/10 patiënten die een 90%-reductie in de ernst en omvang van hun psoriasis bereikten na 16 weken behandeling. [6, 7].
de effectiviteit van secukinumab blijft ook op lange termijn behouden: meer dan 9/10 patiënten behielden hun PASI-respons gedurende maximaal 5 jaar in de SCULPTURE-extensiestudie (N = 168) [8].
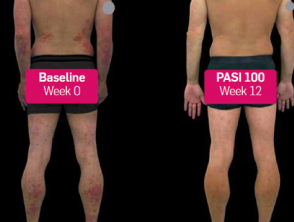
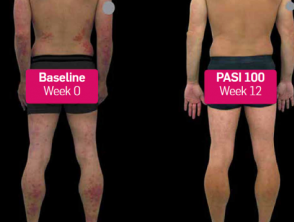
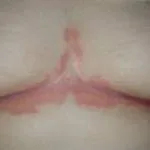
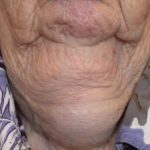
Psoriasis vóór en 3 maanden na het starten van secukinumab
Voor en na secukinumab
Hoe goed wordt secukinumab verdragen bij psoriasis?
Secukinumab heeft een goed verdragen veiligheidsprofiel, met een lage gerapporteerde immunogeniciteit. [1].
Minder dan 1%-patiënten ervaren reacties op de injectieplaats. In klinische onderzoeken de meest voorkomende bijwerkingen (>2%) kwamen uit de bovenste luchtwegen infecties (Vaker nasofaryngitis (11.4%) en rhinitis (2.5%)) en diarree (4.1%). De meeste voorvallen waren licht of matig van ernst. [1].
Als u een van de volgende tekenen of symptomen ervaart, dient u contact op te nemen met uw arts. [9].
- Koortsgriepachtige symptomen, nachtelijk zweten
- Zich moe of kortademig voelen. een hoest die niet weggaat
- Hete, rode, pijnlijke huid of pijnlijke huid uitslag met blaren
- Branden tijdens het urineren
- Moeilijkheden met ademhalen of slikken
- Lage bloeddruk, wat duizeligheid of duizeligheid kan veroorzaken.
- Zwelling van het gezicht, de lippen, mond of keel.
- Ernstig jeukende huid, met rode uitslag of bultjes
Secukinumab heeft een vastgesteld veiligheidsprofiel; er werden geen nieuwe veiligheidssignalen waargenomen bij patiënten die tot 5 jaar lang met secukinumab werden behandeld in het SCULPTURE-extensieonderzoek [8].
Secukinumab heeft een veiligheidsprofiel aangetoond dat vergelijkbaar is met dat van ustekinumab en etanercept. [5, 6].
Lees meer over belangrijk bewijsmateriaal uit klinische onderzoeken met secukinumab.
Hoe wordt secukinumab toegediend?
Secukinumab wordt toegediend door onderhuids injectie. De gebruikelijke dosis voor psoriasis is 300 mg in week 0, 1, 2, 3 en 4, gevolgd door 300 mg elke 4 weken. Elke dosis van 300 mg wordt toegediend in twee injecties van 150 mg. [1].
Na het eerste advies en de training van een beroepsbeoefenaar in de gezondheidszorg kunnen patiënten zelf secukinumab in de dij of buik toedienen met een vooraf bereide SensoReady-pen, of hun verzorger in de bovenarmen. Elke SensoReady-pen bevat een dosis secukinumab van 150 mg. Voor elke set injecties moet een andere plaats worden gebruikt om de pijn te verminderen en te voorkomen dat de huid gevoelig, rood, gekneusd of hard wordt. [1].
Secukinumab moet tot kort vóór de injectie in de koelkast worden bewaard bij 2-8°C. [1].
Secukinumab kan alleen worden toegediend of, indien nodig, in combinatie met methotrexaat. [1].
Voorzorgsmaatregelen die nodig zijn voor patiënten die secukinumab gebruiken
Secukinumab heeft het potentieel om het risico op infecties te verhogen, dus voorzichtigheid is geboden bij het overwegen van het gebruik van secukinumab bij patiënten met een chronische ziekte. infectie, of een verhaal van terugkerend infectie [1].
In klinische onderzoeken naar psoriasis was de meerderheid van de infecties die werden waargenomen bij patiënten die secukinumab kregen licht of matig van ernst. niet serieus candida Infecties werden vaker gemeld bij patiënten die werden behandeld met secukinumab (1.2%) dan bij patiënten die werden behandeld met secukinumab (1.2%). placebo (0,3%) [1].
Patiënten moeten de instructie krijgen om medisch advies in te winnen als zich tekenen of symptomen voordoen die op een infectie wijzen. Als een patiënt een ernstige infectie ontwikkelt, moet de patiënt nauwlettend worden gevolgd en mag secukinumab niet worden toegediend totdat de infectie is verdwenen. [1].
Secukinumab gaat niet gepaard met een stijging gevoeligheid aan tuberculose (tbc). Patiënten moeten worden gescreend op tuberculose voordat de behandeling met secukinumab wordt gestart, en secukinumab mag niet worden toegediend aan patiënten met actieve tuberculose. [1].
Voorzichtigheid is geboden bij het voorschrijven van secukinumab aan patiënten met actieve ziekte van Crohn exacerbaties Ze zijn waargenomen in klinische onderzoeken met secukinumab. Patiënten met actieve ziekte van Crohn moeten nauwlettend worden gevolgd wanneer ze worden behandeld met secukinumab. [1].
Ja anafylaxie of andere ernstige allergische reactie optreedt, moet secukinumab onmiddellijk worden gestaakt en een passende behandeling worden gestart. De SensoReady-pen heeft een latex rubberen stop. Hoewel er in de dop geen natuurlijk rubberlatex wordt aangetroffen, is het veilige gebruik van de SensoReady-pen bij mensen die gevoelig zijn voor latex niet onderzocht. [1].
Patiënten die met secukinumab worden behandeld, mogen tijdens de behandeling geen levende vaccins krijgen. [1].
therapeutisch Controle dient te worden overwogen bij patiënten die met dit middel worden behandeld gelijktijdig CYP450 substraten met een smalle therapeutische index [1].
Gebruik van secukinumab bij speciale patiëntengroepen
Bij oudere patiënten (≥ 65 jaar) is geen dosisaanpassing nodig. In farmacokinetiek studies was de klaring van secukinumab vergelijkbaar tussen ouderen en ouderen <65 años [1].
Secukinumab is niet specifiek onderzocht bij patiënten met nier of lever verslechtering, zodat er geen doseringsaanbevelingen kunnen worden gedaan [1].
De veiligheid en werkzaamheid van secukinumab in pediatrisch patiënten jonger dan 18 jaar is nog niet vastgesteld [1].
Gebruik van secukinumab tijdens de zwangerschap (categorie C)
Er zijn onvoldoende gegevens over het gebruik van secukinumab bij zwangere vrouwen. [1].
ontwikkelingsgericht toxiciteit Uit onderzoek bij apen is geen bewijs gebleken dat secukinumab schade toebrengt aan de foetus. [1].
Secukinumab mag alleen tijdens de zwangerschap worden gebruikt als de voordelen duidelijk opwegen tegen de mogelijke risico’s [1].
Als secukinumab tijdens de zwangerschap is gebruikt, wordt toediening van levende vaccins aan pasgeborenen/zuigelingen over het algemeen niet aanbevolen gedurende 16 weken na de laatste dosis secukinumab aan de moeder. [1].
Voorzichtigheid is geboden bij vrouwen die borstvoeding geven, omdat niet bekend is of secukinumab of de bijbehorende stof wordt gebruikt metabolieten Ze zijn aanwezig in de moedermelk [1].
Follow-up tijdens de behandeling met secukinumab
Het wordt aanbevolen dat patiënten die biologische medicijnen gebruiken, ongeveer elke zes maanden routinematige bloedtesten ondergaan, inclusief volledige bloedtellingen en leverfunctietesten.