Introducción
El secukinumab pertenece a la clase de tratamientos biológicos conocidos como monoclonal anticuerpos. El nombre comercial de secukinumab es Cosentyx® (Novartis AG) [1].
Secukinumab está autorizado para el tratamiento de moderados a graves. placa psoriasis en pacientes adultos que son candidatos a sistémico terapia (un fármaco que se absorbe en el torrente sanguíneo y se distribuye a todas las partes del cuerpo, por ejemplo, metotrexato, acitretina o ciclosporina) o fototerapia (fototerapia). También está aprobado para el tratamiento de psoriásicos. artritis y espondilitis anquilosante [1].
Secukinumab fue aprobado por la Administración de Drogas y Alimentos de los Estados Unidos (FDA) en enero de 2015, y el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos recomendó la autorización de comercialización para secukinumab.
En Nueva Zelanda, secukinumab se clasificó como medicamento recetado en agosto de 2015. Secukinumab se ha financiado en Nueva Zelanda como tratamiento de primera y segunda línea para casos graves crónico psoriasis en placa en solicitud de autoridad especial desde octubre de 2018 [2].
¿Cómo actúa secukinumab?
Interleucina-17A (IL-17A) es una piedra angular citocina (Mensajero proteína) involucrado en el desarrollo de la psoriasis y se encuentra en altas concentraciones en la psoriasis placas [3]. Ver interleucina-17 en inflamatorio trastornos de la piel.
Secukinumab es un monoclonal IgG1 humano anticuerpo que se une selectivamente a IL-17A, inhibiendo rápidamente sus efectos proinflamatorios [3,4].
¿Qué tan efectivo es secukinumab en la psoriasis?
Una gran cantidad de datos respaldan la efectividad de secukinumab para reducir la actividad de la enfermedad (PASI puntuación) en pacientes con psoriasis, con un inicio de acción rápido y un perfil de seguridad favorable [1, 5–8].
Se ha demostrado que secukinumab actúa rápidamente para aliviar eficazmente los síntomas de la psoriasis. [5–7]. El estudio ERASURE (N = 738) informó una reducción del 50% en media Puntaje PASI desde la semana 3 [5]. El estudio CLEAR (N = 676) mostró que 5/10 pacientes lograron reducciones del 75% en la puntuación PASI en la semana 4, que aumentó a 8/10 pacientes logrando una reducción del 90% en la gravedad y extensión de su psoriasis después de 16 semanas de tratamiento. [6, 7].
los eficacia de secukinumab también se mantiene a largo plazo: más de 9/10 pacientes mantuvieron su respuesta PASI hasta por 5 años en el estudio de extensión SCULPTURE (N = 168) [8].
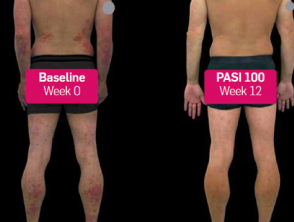
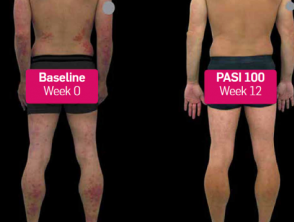
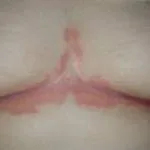
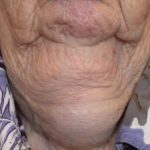
Psoriasis antes y 3 meses después de comenzar con secukinumab
Antes y después de secukinumab
¿Qué tan bien se tolera secukinumab en la psoriasis?
Secukinumab tiene un perfil de seguridad bien tolerado, con baja inmunogenicidad informada. [1].
Menos del 1% de los pacientes experimentan reacciones en el lugar de la inyección. En los ensayos clínicos, los más frecuentes eventos adversos (> 2%) eran del tracto respiratorio superior infecciones (más frecuentemente nasofaringitis (11,4%) y rinitis (2,5%)) y diarrea (4,1%). La mayoría de los eventos fueron de gravedad leve o moderada. [1].
Si experimenta alguno de los siguientes signos o síntomas, debe comunicarse con su médico. [9].
- Fiebre, síntomas similares a los de la gripe, sudores nocturnos
- Sensación de cansancio o falta de aire. una tos que no se va
- Piel caliente, enrojecida y dolorosa, o piel dolorida erupción con ampollas
- Ardor al orinar
- Dificultad para respirar o tragar
- Presión arterial baja, que puede causar mareos o aturdimiento.
- Hinchazón de la cara, labios, boca o garganta.
- Picazón intensa de la piel, con sarpullido rojo o protuberancias elevadas
Secukinumab tiene un perfil de seguridad establecido; no se observaron nuevas señales de seguridad en pacientes tratados con secukinumab durante un máximo de 5 años en el estudio de extensión SCULPTURE [8].
Secukinumab ha demostrado un perfil de seguridad comparable al de ustekinumab y etanercept. [5, 6].
Obtenga más información sobre las pruebas clave de ensayos clínicos con secukinumab.
¿Cómo se administra secukinumab?
Secukinumab se administra por subcutáneo inyección. La dosis habitual para la psoriasis es de 300 mg en las semanas 0, 1, 2, 3 y 4, seguida de 300 mg cada 4 semanas. Cada dosis de 300 mg se administra en dos inyecciones de 150 mg. [1].
Después del asesoramiento y la formación inicial de un profesional sanitario, los pacientes pueden autoadministrarse secukinumab en el muslo o el abdomen con una pluma SensoReady preparada previamente, o bien su cuidador en la parte superior de los brazos. Cada pluma SensoReady contiene una dosis de 150 mg de secukinumab. Se debe usar un sitio diferente para cada conjunto de inyecciones para reducir el dolor y evitar que la piel se vuelva sensible, enrojecida, amoratada o dura. [1].
Secukinumab debe mantenerse refrigerado a 2-8 ° C hasta poco antes de la inyección. [1].
Secukinumab se puede administrar solo o si es necesario, en combinación con metotrexato. [1].
Precauciones necesarias para los pacientes que toman secukinumab
Secukinumab tiene el potencial de aumentar el riesgo de infecciones, por lo que se debe tener precaución al considerar el uso de secukinumab en pacientes con una enfermedad crónica. infección, o una historia de recurrente infección [1].
En los estudios clínicos de psoriasis, la mayoría de las infecciones observadas en pacientes que recibieron secukinumab fueron de intensidad leve o moderada. No serio Candida Las infecciones se notificaron con mayor frecuencia en pacientes tratados con secukinumab (1,2%) frente a placebo (0,3%) [1].
Se debe indicar a los pacientes que busquen consejo médico si se presentan signos o síntomas que sugieran una infección. Si un paciente desarrolla una infección grave, se debe vigilar de cerca al paciente y no se debe administrar secukinumab hasta que la infección se resuelva. [1].
Secukinumab no está asociado con un aumento susceptibilidad a la tuberculosis (TB). Se debe evaluar a los pacientes para detectar TB antes de iniciar el tratamiento con secukinumab, y no se debe administrar secukinumab a pacientes con TB activa. [1].
Se debe tener precaución al prescribir secukinumab a pacientes con enfermedad de Crohn activa, ya que exacerbaciones Se han observado en ensayos clínicos con secukinumab. Los pacientes con enfermedad de Crohn activa deben ser controlados de cerca cuando estén en tratamiento con secukinumab. [1].
Si anafilaxia u otro serio reacción alérgica ocurre, se debe suspender el secukinumab inmediatamente e iniciar la terapia apropiada. La pluma SensoReady tiene un tapón de goma de látex. Aunque no se detecta látex de caucho natural en el capuchón, no se ha estudiado el uso seguro de la pluma SensoReady en personas sensibles al látex. [1].
Los pacientes tratados con secukinumab no deben recibir vacunas vivas durante el tratamiento. [1].
Terapéutico Se debe considerar la monitorización en pacientes en tratamiento con concomitante CYP450 sustratos con un índice terapéutico estrecho [1].
Uso de secukinumab en grupos especiales de pacientes
No es necesario ajustar la dosis en pacientes de edad avanzada (≥ 65 años). En farmacocinética estudios, el aclaramiento de secukinumab fue similar entre los pacientes de edad avanzada y los <65 años [1].
Secukinumab no se ha estudiado específicamente en pacientes con renal o hepático deterioro, por lo que no se pueden hacer recomendaciones de dosis [1].
La seguridad y eficacia de secukinumab en pediátrico pacientes menores de 18 años todavía no se ha establecido [1].
Uso de secukinumab en el embarazo (categoría C)
No existen datos suficientes para el uso de secukinumab en mujeres embarazadas. [1].
De desarrollo toxicidad Los estudios realizados con monos no encontraron evidencia de daño al feto debido a secukinumab. [1].
Secukinumab solo debe usarse durante el embarazo si los beneficios superan claramente los riesgos potenciales [1].
Si se ha utilizado secukinumab durante el embarazo, generalmente no se recomienda la administración de vacunas vivas a recién nacidos / lactantes durante 16 semanas después de la última dosis de secukinumab de la madre. [1].
Se debe tener precaución en mujeres que estén amamantando, ya que no se sabe si secukinumab o su metabolitos están presentes en la leche materna [1].
Seguimiento durante el tratamiento con secukinumab
Se recomienda que los pacientes que toman medicamentos biológicos se realicen análisis de sangre de rutina cada 6 meses aproximadamente, incluidos hemogramas completos y pruebas de función hepática.