Was ist es erblich Angioödem?
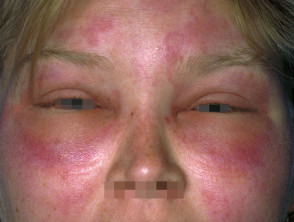
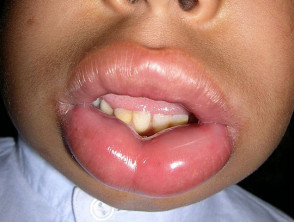
Hereditäres Angioödem ist selten, autosomal dominante Krankheit mit einem Mangel verbunden oder Funktionsstörung C1-Esterase-Inhibitor (C1-INH) Aktivität. Hereditäres Angioödem verursacht spontane, wiederkehrendund lebensbedrohliche Schwellung in verschiedenen Regionen des Körpers, einschließlich der Larynx.
Angioödem
Was ist Lanadelumab?
Lanadelumab (auch Lanadelumab-Flyo genannt) ist eine verschriebene biologische Behandlung, die bei Patienten ab 12 Jahren angewendet wird, um schwere Schwellungsattacken aufgrund eines hereditären Angioödems zu verhindern. Es ist der erste monoklonal Antikörper verfügbar für erbliches Angioödem.
Lanadelumab wurde im August 2018 von der US-amerikanischen Food and Drug Administration (FDA), im September 2018 in Kanada und im November 2018 von der Europäischen Kommission zugelassen Vermarktung von Lanadelumab. Lanadelumab ist derzeit in Neuseeland nicht erhältlich.
Lanadelumab wird unter dem Markennamen Takhzyro ™ von Dyax Corp (einer Tochtergesellschaft von Shire) mit Sitz in Burlington, MA, USA, vermarktet.
Wie wirkt Lanadelumab?
Lanadelumab ist völlig menschlich Immunoglobulin G1, monoklonaler Kappa-Leichtketten-Antikörper, der liefert Hemmung von Plasma Kallikrein, ein kritischer Regulator für erbliche Angioödem-Attacken.
- Die Aktivität von Plasma-Kallikrein wird durch die Aktivität von C1-INH reguliert.
- C1-INH-Mangel oder -Dysfunktion führen zu unkontrollierten Erhöhungen der Plasma-Kallikrein-Aktivität.
- Plasma Kallikrein ist ein Protease das funktioniert durch Teilen des Hochs molekular Gewichtskininogen (a Koagulation Protein), um die zu generierenentzündlich Peptid Bradykinin. Bradykinin ist ein starker Vasodilatator und nimmt zu vaskulär PermeabilitätDies ist die Ursache für die Schwellung und die Schmerzen, die mit einem erblichen Angioödem verbunden sind.
- Lanadelumab verstopft die proteolytisch aktives Zentrum von Plasma-Kallikrein, das die Teilung von Kininogen in Bradykinin verhindert.
- Lanadelumab reduziert daher die Aktivität von Plasma-Kallikrein und Bradykinin bei Patienten mit hereditärem Angioödem.
Was ist der Hinweis auf Lanadelumab?
Lanadelumab ist angezeigt, um wiederkehrende Anfälle eines hereditären Angioödems bei Patienten ab 12 Jahren zu verhindern.
- Es ist nicht zur Behandlung von akut Anfälle von erblichem Angioödem.
- Die Behandlung sollte unter Aufsicht eines Arztes begonnen werden, der Erfahrung in der Behandlung von Patienten mit hereditärem Angioödem hat.
Wie wird Lanadelumab verabreicht?
Lanadelumab kann vom Patienten selbst oder von einer Pflegekraft nach dem Training am verabreicht werden subkutan Injektionstechnik durch einen Arzt.
- Die empfohlene Anfangsdosis beträgt 300 mg Lanadelumab durch subkutane Injektion alle 2 Wochen.
- Die Injektion sollte auf die empfohlenen Injektionsstellen (Bauch, Oberschenkel und obere Außenarme) beschränkt sein und die Injektionsstelle nach Bedarf drehen.
- Bei Patienten ohne Schwellungsanfälle während der Behandlung kann die Dosis alle 4 Wochen auf 300 mg reduziert werden.
- Wenn eine Dosis Lanadelumab versäumt wird, sollte die vergessene Dosis so bald wie möglich verabreicht werden, wobei zwischen den Dosen mindestens 10 Tage zu beachten sind.
Kontraindikationen nach Lanadelumab
Die Haupt Kontraindikation Lanadelumab ist Überempfindlichkeit zum Aktive Substanz oder zu einem der Hilfsstoffe.
Warnungen und Vorsichtsmaßnahmen
Rückverfolgbarkeit
Um die Rückverfolgbarkeit von biologischen Arzneimitteln zu verbessern, sollten Name und Chargennummer des verabreichten Lanadelumab eindeutig aufgezeichnet werden.
Überempfindliche Reaktionen
Überempfindlichkeitsreaktionen gegen Lanadelumab wurden beobachtet. Im Falle einer schweren Überempfindlichkeitsreaktion sollte Lanadelumab sofort abgesetzt und eine angemessene Behandlung eingeleitet werden.
Allgemeines
Lanadelumab ist nicht zur Behandlung von akuten Anfällen eines hereditären Angioödems indiziert. Im Falle eines Durchbruchangioödems sollte eine individuelle Behandlung mit zugelassenen Rettungsmedikamenten eingeleitet werden.
Es liegen keine klinischen Daten zur Anwendung von Lanadelumab bei Patienten mit hereditärem Angioödem mit normaler C1-INH-Aktivität vor.
Dosisänderung
Patienten mit Nieren- Behinderung
Es wurden keine Studien bei Patienten unter Lanadelumab mit schwerem Nierenversagen durchgeführt. Es ist nicht zu erwarten, dass eine Nierenfunktionsstörung die Lanadelumab-Exposition oder das Sicherheitsprofil beeinflusst. Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich.
Patienten mit hepatisch Behinderung
Bei Patienten unter Lanadelumab mit Leberfunktionsstörung ist keine Dosisanpassung erforderlich. Es ist nicht zu erwarten, dass eine Leberfunktionsstörung die Exposition gegenüber Lanadelumab beeinflusst. Es gibt keine Studien bei Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung.
Alte Leute
Bei Patienten über 65 Jahren ist keine Dosisanpassung erforderlich, da das Alter die Exposition gegenüber Lanadelumab voraussichtlich nicht beeinflusst.
Kinder
Sicherheit und Wirksamkeit Lanadelumab bei Kindern unter 12 Jahren wurde nicht nachgewiesen. Keine Daten verfügbar.
Verwendung von Lanadelumab in bestimmten Populationen
Schwangere Frau
Es liegen keine Daten zur Anwendung von Lanadelumab bei schwangeren Frauen vor, um die mit dem Medikament verbundenen Risiken zu ermitteln. Monoklonal Antikörper Wie Lanadelumab kann es im dritten Schwangerschaftstrimester die Plazenta passieren und möglicherweise schädliche Auswirkungen auf den Fötus haben. Studien zu Lanadelumab bei schwangeren Frauen Cynomolgus-Affen, behandelt mit dem 33-fachen der empfohlenen Höchstdosis für Menschen, ergab keine Hinweise auf eine Schädigung Entwicklung Fötus.
Stillende Mutter
Es ist nicht bekannt, ob Lanadelumab oder seine Metaboliten werden in die Muttermilch ausgeschieden. Da viele Medikamente in die Muttermilch übergehen, sollten Mütter vor der Anwendung von Lanadelumab mit dem Stillen aufhören. Verfügbar Pharmakokinetik Daten bei Cynomolgus-Affen haben gezeigt, dass die Ausscheidung von Lanadelumab in der Milch ungefähr 0,21 TP1T des mütterlichen Plasmaspiegels beträgt.
Kinder
Die Sicherheit und Wirksamkeit von Lanadelumab bei Kindern unter 12 Jahren wurde nicht nachgewiesen.
Alte Leute
In klinischen Studien wurden keine allgemeinen Unterschiede in Bezug auf Sicherheit oder Wirksamkeit zwischen Patienten über 65 Jahren und jüngeren Patienten, die mit Lanadelumab behandelt wurden, beobachtet.
Personen im gebärfähigen Alter
Die Wirkung von Lanadelumab auf die Fruchtbarkeit wurde beim Menschen nicht untersucht. Lanadelumab hatte keinen Einfluss auf die männliche oder weibliche Fruchtbarkeit bei Cynomolgus-Affen.
Was sind die möglichen Wechselwirkungen mit Lanadelumab?
Mit Lanadelumab wurden keine spezifischen Arzneimittel-Arzneimittel-Wechselwirkungsstudien durchgeführt. Aufgrund seiner Eigenschaften sind pharmakokinetische Wechselwirkungen mit gleichzeitig verabreichten Arzneimitteln nicht zu erwarten.
Interaktion mit dem aPPT-Assay
- Lanadelumab kann aufgrund einer Wechselwirkung mit dem aPTT-Assay die aktivierte partielle Thromboplastinzeit (aPTT) verlängern.
- Reagenzien Der im aPTT-Labortest verwendete Test initiiert die intrinsische Koagulation durch Aktivierung von Plasma-Kallikrein im Kontaktaktivierungssystem.
- Die Hemmung von Plasma-Kallikrein durch Lanadelumab kann die aPTT in diesem Assay erhöhen.
Was sind die möglichen Nebenwirkungen von Lanadelumab?
Die häufigsten Nebenwirkungen bei Patienten, die Lanadelumab in klinischen Studien erhalten haben, sind nachstehend beschrieben.
Nebenwirkungen mit mehr als 10% Vorfall
Bei einer Dosis von Lanadelumab 300 mg alle 2 Wochen die folgenden Nebenwirkungen Wo siehst du:
- Reaktionen an der Injektionsstelle, einschließlich Schmerzen Erythemund Blutergüsse (56%)
- Obere Atemwege Infektion (44%)
- Kopfschmerzen (33%)
- Myalgie (11%).
Bei einer Dosis von 300 mg Lanadelumab alle 4 Wochen wurden die folgenden Nebenwirkungen beobachtet:
- Reaktionen an der Injektionsstelle (45%)
- Infektion der oberen Atemwege (31%)
- Kopfschmerz (21%).
Nebenwirkungen einer Inzidenz von 1 bis 10%
Zu den mit Lanadelumab beobachteten Nebenwirkungen von 1 bis 10% gehören:
- Alanintransferase erhöht (ALT) und Aspartattransferase (AST) Leber Enzyme (2%)
- Überempfindlichkeit (1%): Symptome einer schweren allergische Reaktion einschließen Urtikaria, Juckreiz / Schwellung (insbesondere von Gesicht, Zunge und Rachen), starker Schwindel und Atembeschwerden.
Bei einer Dosis von 300 mg Lanadelumab alle 2 Wochen wurden die folgenden Nebenwirkungen beobachtet:
- Eruption (4%)
- Schwindel (4%)
- Durchfall (4%).
Bei einer Dosis von 300 mg Lanadelumab alle 4 Wochen wurden die folgenden Nebenwirkungen beobachtet:
- Hautausschlag (10%)
- Schwindel (10%).
Immunogenität
Die Behandlung mit Lanadelumab wurde in Verbindung gebracht Entwicklung von Anti-Arzneimittel-Antikörpern bei 10 von 84 Patienten (11.9%). Alle Antikörper Titel Sie waren kurz. Die Anti-Arzneimittel-Antikörperantwort war vorübergehend im 20% der Probanden positiv für Anti-Arzneimittel-Antikörper; Zwei der 84 mit Lanadelumab (2.4%) behandelten Patienten wurden positiv auf neutralisierende Antikörper getestet.
Die Entwicklung von Anti-Arzneimittel-Antikörpern, einschließlich neutralisierender Antikörper gegen Lanadelumab, schien die Pharmakokinetik nicht nachteilig zu beeinflussen pharmakodynamisch Profile oder klinisches Ansprechen.