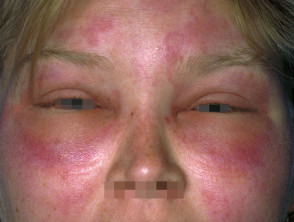
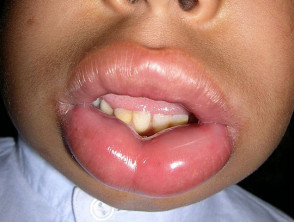
Wat is erfgenaam angio-oedeem?
Erfelijk angio-oedeem is zeldzaam, autosomaal dominante ziekte die gepaard gaat met een tekort of disfunctie van C1-esterase-remmer (C1-INH) activiteit. Erfelijk angio-oedeem veroorzaakt spontane, terugkerenden levensbedreigende zwelling in verschillende delen van het lichaam, waaronder de strottenhoofd.
angio-oedeem
Wat is lanadelumab?
Lanadelumab (ook wel lanadelumab-flyo genoemd) is een biologische behandeling op recept die wordt gebruikt bij patiënten van 12 jaar en ouder om ernstige zwellingen als gevolg van erfelijk angio-oedeem te voorkomen. Het is de eerste monoklonaal antilichaam beschikbaar voor erfelijk angio-oedeem.
Lanadelumab werd goedgekeurd door de Amerikaanse Food and Drug Administration (FDA) in augustus 2018, in Canada in september 2018 en door de Europese Commissie in november 2018. In Australië worden ook regelgevende aanvragen overwogen voor het op de markt brengen van lanadelumab. Lanadelumab is momenteel niet beschikbaar in Nieuw-Zeeland.
Lanadelumab wordt op de markt gebracht onder de merknaam Takhzyro™ door het in Burlington, MA, VS gevestigde Dyax Corp (een dochteronderneming van Shire).
Hoe werkt lanadelumab?
Lanadelumab is volledig menselijk immunoglobuline G1, kappa lichte keten monoklonaal antilichaam dat zorgt voor remming van plasma kallikrein, een kritische regulator van erfelijke angio-oedeemaanvallen.
- Plasma-kallikreïne-activiteit wordt gereguleerd door C1-INH-activiteit.
- C1-INH-deficiëntie of disfunctie leidt tot ongecontroleerde verhogingen van de activiteit van kallikreïne in het plasma.
- Plasmakallikreïne is een protease die werkt door de high te verdelen moleculair gewicht kininogeen (a coagulatie eiwit) om de pro-opruiend peptide bradykinine. Bradykinine is een krachtige vasodilatator en neemt toe vasculair doorlaatbaarheid, wat de oorzaak is van de zwelling en pijn geassocieerd met erfelijk angio-oedeem.
- Lanadelumab belemmert de proteolytisch actieve plaats van plasmakallikreïne, waardoor de splitsing van kininogeen in bradykinine wordt voorkomen.
- Lanadelumab vermindert daarom de activiteit van kallikreïne en bradykinine in het plasma bij patiënten met erfelijk angio-oedeem.
Wat is de indicatie voor lanadelumab?
Lanadelumab is geïndiceerd om terugkerende aanvallen van erfelijk angio-oedeem te voorkomen bij patiënten van 12 jaar en ouder.
- Het is niet bedoeld voor de behandeling van scherp erfelijke angio-oedeemaanvallen.
- De behandeling moet worden gestart onder toezicht van een arts die ervaring heeft met de behandeling van patiënten met erfelijk angio-oedeem.
Hoe wordt lanadelumab toegediend?
Lanadelumab kan door de patiënt zelf worden toegediend of door een verzorger worden toegediend na training onderhuids injectietechniek door een beroepsbeoefenaar in de gezondheidszorg.
- De aanbevolen startdosering is 300 mg lanadelumab door subcutane injectie elke 2 weken.
- De injectie moet worden beperkt tot de aanbevolen injectieplaatsen (buik, dijen en bovenarmen), waarbij de injectieplaats zo nodig moet worden geroteerd.
- Bij patiënten die tijdens de behandeling geen zwellingsaanvallen krijgen, kan de dosis worden verlaagd tot 300 mg om de 4 weken.
- Als een dosis lanadelumab wordt gemist, moet de gemiste dosis zo snel mogelijk worden toegediend, waarbij er ten minste 10 dagen tussen de doses moet zitten.
Contra-indicaties naar lanadelumab
de belangrijkste contra-indicatie naar lanadelumab is overgevoeligheid naar de werkzame stof of naar een van de hulpstoffen.
Waarschuwingen en voorzorgsmaatregelen
traceerbaarheid
Om de traceerbaarheid van biologische geneesmiddelen te verbeteren, moeten de naam en het partijnummer van het toegediende lanadelumab duidelijk worden vastgelegd.
overgevoelige reacties
Overgevoeligheidsreacties op lanadelumab zijn waargenomen. In het geval van een ernstige overgevoeligheidsreactie moet lanadelumab onmiddellijk worden stopgezet en moet een geschikte behandeling worden gestart.
Algemeen
Lanadelumab is niet geïndiceerd voor de behandeling van acute aanvallen van erfelijk angio-oedeem. In het geval van doorbraak angio-oedeem moet een geïndividualiseerde behandeling met goedgekeurde noodmedicatie worden gestart.
Er zijn geen klinische gegevens beschikbaar over het gebruik van lanadelumab bij patiënten met erfelijk angio-oedeem met normale C1-INH-activiteit.
Dosis wijziging
Patiënten met nier onbekwaamheid
Er zijn geen onderzoeken uitgevoerd bij patiënten die lanadelumab gebruiken en die een ernstige nierfunctiestoornis hebben. Een nierfunctiestoornis heeft naar verwachting geen invloed op de blootstelling aan lanadelumab of het veiligheidsprofiel ervan. Er is geen dosisaanpassing nodig bij patiënten met nierinsufficiëntie.
Patiënten met lever onbekwaamheid
Er is geen dosisaanpassing nodig bij patiënten die lanadelumab gebruiken en die een leverfunctiestoornis hebben. Leverinsufficiëntie heeft naar verwachting geen invloed op de blootstelling aan lanadelumab. Er zijn geen studies uitgevoerd bij patiënten met een matige of ernstige leverfunctiestoornis.
Oude mensen
Er is geen dosisaanpassing nodig voor patiënten ouder dan 65 jaar, omdat leeftijd naar verwachting geen invloed heeft op de blootstelling aan lanadelumab.
Kinderen
veiligheid en effectiviteit van lanadelumab bij kinderen jonger dan 12 jaar is niet vastgesteld. Geen gegevens beschikbaar.
Gebruik van lanadelumab in specifieke populaties
Zwangere vrouw
Er zijn geen gegevens beschikbaar over het gebruik van lanadelumab bij zwangere vrouwen om geneesmiddelgerelateerde risico's te melden. monoklonaal antistoffen aangezien lanadelumab de placenta kan passeren tijdens het derde trimester van de zwangerschap met mogelijk schadelijke effecten op de foetus. Studies van lanadelumab bij zwangere vrouwen cynomolgus apen, behandeld met 33 keer de maximaal aanbevolen dosis voor de mens, onthulde geen bewijs van schade aan de ontwikkelen foetus.
zogende moeders
Het is niet bekend of lanadelumab of zijn metabolieten Ze worden uitgescheiden in de moedermelk. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk, moeten moeders stoppen met borstvoeding voordat ze lanadelumab gebruiken. Beschikbaar farmacokinetiek Gegevens bij cynomolgusapen hebben aangetoond dat de uitscheiding van lanadelumab in melk ongeveer 0,2% is van de maternale plasmaspiegel.
Kinderen
De veiligheid en werkzaamheid van lanadelumab bij kinderen jonger dan 12 jaar zijn niet vastgesteld.
Oude mensen
In klinische onderzoeken zijn er geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen patiënten ouder dan 65 jaar en jongere patiënten die met lanadelumab werden behandeld.
Personen in de vruchtbare leeftijd
Het effect van lanadelumab op de vruchtbaarheid is niet onderzocht bij mensen. Lanadelumab had geen effect op de mannelijke of vrouwelijke vruchtbaarheid bij cynomolgusapen.
Wat zijn de mogelijke geneesmiddelinteracties met lanadelumab?
Er zijn geen specifieke geneesmiddelinteractiestudies uitgevoerd met lanadelumab. Op basis van de kenmerken ervan worden geen farmacokinetische interacties met gelijktijdig toegediende geneesmiddelen verwacht.
Interactie met de aPPT-assay
- Lanadelumab kan de geactiveerde partiële tromboplastinetijd (aPTT) verlengen als gevolg van een interactie met de aPTT-assay.
- reagentia gebruikt in de aPTT-laboratoriumtest initiëren intrinsieke coagulatie door activering van plasmakallikreïne in het contactactiveringssysteem.
- Remming van plasmakallikreïne door lanadelumab kan de aPTT in deze assay verhogen.
Wat zijn de mogelijke bijwerkingen van lanadelumab?
De meest voorkomende bijwerkingen bij patiënten die in klinische studies lanadelumab kregen, worden hieronder beschreven.
Bijwerkingen met meer dan 10% incidentie
Bij een dosis lanadelumab 300 mg elke 2 weken, het volgende Bijwerkingen Waar je ziet:
- Reacties op de injectieplaats, waaronder pijn, erytheemen blauwe plekken (56%)
- bovenste luchtwegen infectie (44%)
- Hoofdpijn (33%)
- Spierpijn (11%).
Bij een dosis 300 mg lanadelumab elke 4 weken werden de volgende bijwerkingen waargenomen:
- Reacties op de injectieplaats (45%)
- Bovenste luchtweginfectie (31%)
- Hoofdpijn (21%).
Bijwerkingen van een incident van 1 tot 10%
Bijwerkingen van 1 tot 10% in incidentie waargenomen met lanadelumab zijn onder meer:
- Verhoogde alaninetransferase (ALT) en aspartaattransferase (AST) lever enzymen (2%)
- Overgevoeligheid (1%): symptomen van een ernstige allergische reactie erbij betrekken netelroos, jeuk/zwelling (vooral van gezicht, tong en keel), ernstige duizeligheid en kortademigheid.
Bij een dosis lanadelumab 300 mg om de 2 weken werden de volgende bijwerkingen waargenomen:
- Uitslag (4%)
- Duizeligheid (4%)
- Diarree (4%).
Bij een dosis 300 mg lanadelumab elke 4 weken werden de volgende bijwerkingen waargenomen:
- Uitbarsting (10%)
- Duizeligheid (10%).
immunogeniciteit
Behandeling met lanadelumab is in verband gebracht met ontwikkelen antilichamen tegen geneesmiddelen bij 10 van de 84 patiënten (11.9%). alle antistoffen Titels ze waren kort. De anti-drug antilichaamrespons was vergankelijk in 20% van proefpersonen positief voor anti-drug antilichamen; twee van de 84 met lanadelumab behandelde patiënten (2.4%) testten positief op neutraliserende antilichamen.
De ontwikkeling van antilichamen tegen het geneesmiddel, waaronder neutraliserende antilichamen tegen lanadelumab, leek geen negatieve invloed te hebben op de farmacokinetiek en farmacodynamisch profielen of klinische respons.