Que es hereditario angioedema?
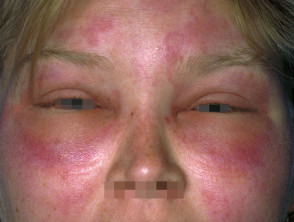
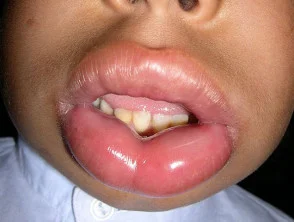
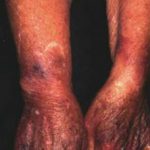
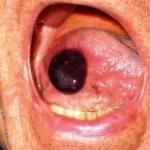
El angioedema hereditario es raro, autosómico enfermedad dominante que se asocia con una deficiencia o disfunción de C1-esterasa-inhibidor (C1-INH) actividad. El angioedema hereditario causa espontáneo, recurrentee hinchazón potencialmente mortal en varias regiones del cuerpo, incluida la laringe.
Angioedema
¿Qué es lanadelumab?
Lanadelumab (también llamado lanadelumab-flyo) es un tratamiento biológico recetado que se usa en pacientes de 12 años o más para prevenir ataques de hinchazón severos debidos a angioedema hereditario. Es el primero monoclonal anticuerpo disponible para angioedema hereditario.
Lanadelumab fue aprobado por la Administración de Drogas y Alimentos de los EE. UU. (FDA) en agosto de 2018, en Canadá en septiembre de 2018 y por la Comisión Europea en noviembre de 2018. En Australia también se están considerando aplicaciones regulatorias para la comercialización de lanadelumab. Lanadelumab no está disponible actualmente en Nueva Zelanda.
Lanadelumab se comercializa bajo la marca Takhzyro ™ por Dyax Corp (una subsidiaria de Shire) con sede en Burlington, MA, EE. UU.
¿Cómo actúa lanadelumab?
Lanadelumab es completamente humano inmunoglobulina G1, anticuerpo monoclonal de cadena ligera kappa que proporciona inhibición de plasma calicreína, un regulador crítico de los ataques de angioedema hereditario.
- La actividad de la calicreína plasmática está regulada por la actividad de C1-INH.
- La deficiencia o disfunción de C1-INH conduce a aumentos incontrolados de la actividad de la calicreína plasmática.
- La calicreína plasmática es una proteasa que funciona dividiendo lo alto molecular cininógeno de peso (un coagulación proteína) para generar el pro-inflamatorio péptido bradicinina. La bradicinina es un potente vasodilatador y aumenta vascular permeabilidad, que es la causa de la hinchazón y el dolor asociados con el angioedema hereditario.
- Lanadelumab obstruye el proteolítico sitio activo de la calicreína plasmática, evitando la división del cininógeno en bradicinina.
- Lanadelumab, por tanto, reduce la actividad de la calicreína y bradicinina plasmática en pacientes con angioedema hereditario.
¿Cuál es la indicación de lanadelumab?
Lanadelumab está indicado para prevenir ataques recurrentes de angioedema hereditario en pacientes de 12 años o más.
- No está destinado al tratamiento de agudo ataques de angioedema hereditario.
- El tratamiento debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de pacientes con angioedema hereditario.
¿Cómo se administra lanadelumab?
Lanadelumab puede ser autoadministrado por el paciente o administrado por un cuidador después de recibir capacitación sobre subcutáneo técnica de inyección por un profesional sanitario.
- La dosis inicial recomendada es de 300 mg de lanadelumab por inyección subcutánea cada 2 semanas.
- La inyección debe limitarse a los lugares de inyección recomendados (abdomen, muslos y parte superior externa de los brazos), rotando el lugar de la inyección según sea necesario.
- En pacientes que no presentan ataques de hinchazón durante el tratamiento, la dosis puede reducirse a 300 mg cada 4 semanas.
- Si se omite una dosis de lanadelumab, la dosis omitida debe administrarse lo antes posible, asegurándose al menos 10 días entre dosis.
Contraindicaciones a lanadelumab
El principal contraindicación a lanadelumab es hipersensibilidad al Substancia activa oa cualquiera de los excipientes.
Advertencias y precauciones
Trazabilidad
Para mejorar la trazabilidad de los medicamentos biológicos, se debe registrar claramente el nombre y el número de lote del lanadelumab administrado.
Reacciones hipersensibles
Se han observado reacciones de hipersensibilidad a lanadelumab. En caso de una reacción de hipersensibilidad grave, debe interrumpirse inmediatamente la administración de lanadelumab e iniciarse el tratamiento adecuado.
General
Lanadelumab no está indicado para el tratamiento de ataques agudos de angioedema hereditario. En el caso de angioedema irruptivo, se debe iniciar un tratamiento individualizado con medicación de rescate aprobada.
No hay datos clínicos disponibles sobre el uso de lanadelumab en pacientes con angioedema hereditario con actividad normal de C1-INH.
Modificación de dosis
Pacientes con renal discapacidad
No se han realizado estudios en pacientes que toman lanadelumab y tienen insuficiencia renal grave. No se espera que la insuficiencia renal afecte la exposición a lanadelumab o su perfil de seguridad. No se requiere ajuste de dosis en pacientes con insuficiencia renal.
Pacientes con hepático discapacidad
No se requiere ajuste de dosis en pacientes que toman lanadelumab y que tienen insuficiencia hepática. No se espera que la insuficiencia hepática afecte la exposición a lanadelumab. No hay estudios en pacientes con insuficiencia hepática moderada o grave.
Personas mayores
No se requiere ajuste de dosis para pacientes mayores de 65 años porque no se espera que la edad afecte la exposición a lanadelumab.
Niños
La seguridad y eficacia de lanadelumab en niños menores de 12 años no se ha establecido. No hay datos disponibles.
Uso de lanadelumab en poblaciones específicas
Mujeres embarazadas
No hay datos disponibles sobre el uso de lanadelumab en mujeres embarazadas para informar sobre los riesgos asociados al fármaco. Monoclonal anticuerpos como lanadelumab puede atravesar la placenta durante el tercer trimestre del embarazo con efectos potencialmente dañinos en el feto. Estudios de lanadelumab en embarazadas monos cynomolgus, tratado con 33 veces la dosis máxima recomendada para humanos, no reveló evidencia de daño al desarrollando feto.
Madres lactantes
No se sabe si lanadelumab o su metabolitos se excretan en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna, las madres deben dejar de amamantar antes de usar lanadelumab. Disponible farmacocinética los datos en monos cynomolgus han demostrado que la excreción de lanadelumab en la leche es aproximadamente del 0,2% del nivel plasmático materno.
Niños
No se ha establecido la seguridad y eficacia de lanadelumab en niños menores de 12 años.
Personas mayores
En los ensayos clínicos, no se han observado diferencias generales en la seguridad o la eficacia entre los pacientes mayores de 65 años y los pacientes más jóvenes tratados con lanadelumab.
Individuos en edad fértil
El efecto de lanadelumab sobre la fertilidad no se ha evaluado en humanos. Lanadelumab no tuvo ningún efecto sobre la fertilidad de machos o hembras en monos cynomolgus.
¿Cuáles son las posibles interacciones farmacológicas con lanadelumab?
No se han realizado estudios específicos de interacción fármaco-fármaco con lanadelumab. En base a sus características, no se esperan interacciones farmacocinéticas con medicamentos administrados concomitantemente.
Interacción con el ensayo aPPT
- Lanadelumab puede aumentar el tiempo de tromboplastina parcial activada (aPTT) debido a una interacción con el ensayo aPTT.
- Reactivos utilizados en la prueba de laboratorio aPTT inician la coagulación intrínseca a través de la activación de la calicreína plasmática en el sistema de activación por contacto.
- La inhibición de la calicreína plasmática por lanadelumab puede aumentar el aPTT en este ensayo.
¿Cuáles son los posibles efectos secundarios de lanadelumab?
Los efectos secundarios más comunes en pacientes que recibieron lanadelumab en ensayos clínicos se describen a continuación.
Efectos secundarios con más del 10% incidencia
A una dosis de lanadelumab 300 mg cada 2 semanas, lo siguiente Reacciones adversas donde se ve:
- Reacciones en el lugar de la inyección, incluido dolor, eritemay hematomas (56%)
- Tracto respiratorio superior infección (44%)
- Dolor de cabeza (33%)
- Mialgia (11%).
A una dosis de lanadelumab 300 mg cada 4 semanas, se observaron las siguientes reacciones adversas:
- Reacciones en el lugar de la inyección (45%)
- Infección del tracto respiratorio superior (31%)
- Dolor de cabeza (21%).
Efectos secundarios de una incidencia del 1 al 10%
Las reacciones adversas de 1 a 10% en incidencia observadas con lanadelumab incluyen:
- Aumento de la alanina transferasa (ALT) y aspartato transferasa (AST) hígado enzimas (2%)
- Hipersensibilidad (1%): síntomas de una grave reacción alérgica incluir urticaria, picazón / hinchazón (especialmente en la cara, lengua y garganta), mareos intensos y dificultad para respirar.
Con una dosis de lanadelumab 300 mg cada 2 semanas, se observaron las siguientes reacciones adversas:
- Erupción (4%)
- Mareos (4%)
- Diarrea (4%).
A una dosis de lanadelumab 300 mg cada 4 semanas, se observaron las siguientes reacciones adversas:
- Erupción (10%)
- Mareos (10%).
Inmunogenicidad
El tratamiento con lanadelumab se ha asociado con la desarrollo de anticuerpos anti-fármaco en 10 de 84 pacientes (11,9%). Todos los anticuerpos títulos eran bajos. La respuesta de anticuerpos antidrogas fue transitorio en el 20% de los sujetos positivos para anticuerpos antidrogas; dos de los 84 pacientes tratados con lanadelumab (2,4%) dieron positivo en anticuerpos neutralizantes.
El desarrollo de anticuerpos antidrogas, incluidos los anticuerpos neutralizantes contra lanadelumab, no pareció afectar negativamente a la farmacocinética y farmacodinámico perfiles o la respuesta clínica.