Was ist Ustekinumab?
Ustekinumab (Markenname STELARA™) ist ein biologisches Medikament zur Behandlung mittelschwerer bis schwerer Psoriasis. Er ist ein Mensch monoklonal Antikörper das widerspricht Interleukin-12 (IL-12) und IL-23. Bei mehr als zwei Dritteln der Patienten wird ein gutes bis ausgezeichnetes Ansprechen beobachtet chronisch Nummernschild Psoriasis, behandelt mit Ustekinumab.
In kleinen Studien wurde gezeigt, dass Ustekinumab bei anderen Formen der Psoriasis nützlich ist, darunter ein Psoriasis, erythrodermische Psoriasis, weit verbreitet pustelartig Psoriasis und palmoplantar Pustulose. Es wird auch zur Behandlung von Psoriasis eingesetzt. Arthritis und Morbus Crohn.
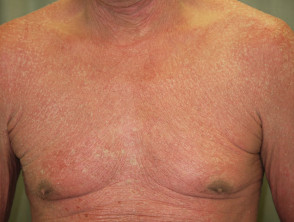
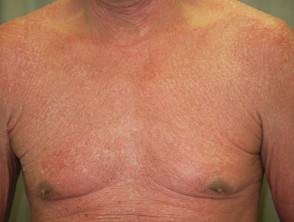
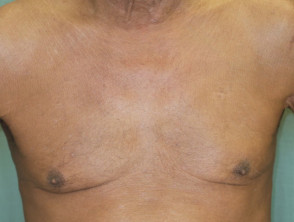
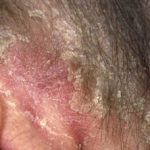
Erythrodermische Psoriasis vor und 2 Wochen nach einer Einzeldosis Ustekinumab
Erythrodermische Psoriasis vor Ustekinumab
Erythrodermische Psoriasis 2 Wochen nach der ersten Dosis Ustekinumab
Wie wirkt Ustekinumab bei Psoriasis?
Psoriasis wird durch eine erhöhte Produktion von verursacht T-Zellen und wird beeinflusst von Zytokine, die von Zellen produzierten chemischen Botenstoffe. Bestimmte Zytokine bewirken, dass Hautzellen schnell wachsen und produzieren Platten von Psoriasis. Ustekinumab ist ein monoklonaler Antikörper, der auf die p40-Untereinheit der Zytokine IL-12 und IL-23 abzielt und diese daran hindert, T- zu binden und zu aktivieren.Lymphozyten.
Ustekinumab-Dosierung
Ustekinumab wird verabreicht von subkutan Injektion. Die zweite Dosis wird 4 Wochen nach der ersten Injektion verabreicht, weitere Dosen werden alle 12 Wochen verabreicht. Die maximale Wirkung erreicht sie etwa nach 28 Wochen.
- Die Dosis für Patienten mit einem Gewicht unter 100 kg beträgt 45 mg.
- Die Dosis für Patienten mit einem Körpergewicht über 100 kg beträgt 90 mg.
- Jede Injektion wird am besten an einer anderen Stelle verabreicht (z. B. Oberarme, Gesäß, Oberschenkel oder Bauch).
Nebenwirkungen wegen Ustekinumab
Bis heute nachteilig Infektionen Sie stimmen mit den Beobachtungen anderer Biologika überein.
- Infektionen: Ustekinumab kann das Risiko von Infektionen und einer Reaktivierung erhöhen latent Schwere Infektionen bakteriellBei Personen, die das Arzneimittel erhielten, wurden Pilz- und Virusinfektionen beobachtet.
- Bösartige Neubildungen: Ustekinumab ist ein Immunsuppressivum und kann das Risiko erhöhen Malignität (Krebs) einschließlich Hautkrebs.
- Während der Anwendung von Ustekinumab nach der Zulassung wurde über Störungen des Immunsystems berichtet. Dazu gehörten schwerwiegende allergische Reaktionen (sogar Angioödem, Kurzatmigkeit und niedriger Blutdruck) und Überempfindlichkeit (Allergie) Reaktionen (einschließlich Eruption und Urtikaria).
- Zu den Reaktionen an der Injektionsstelle zählen Schmerzen, Schwellung, Juckreiz, Verdickung, Blutungen und Blutergüsse.
Vorsichtsmaßnahmen bei der Erwägung von Ustekinumab
- Chronisch Infektion oder eine Geschichte von wiederkehrend Infektion. Ustekinumab sollte nicht verabreicht werden, bis die Infektion abgeklungen ist oder angemessen behandelt wird.
- Bei Patienten, die mit Ustekinumab behandelt werden, kann dies der Fall sein anfällig zu Infektionen (einschließlich Tuberkulose, atypisch Mykobakterien), Salmonellen (einschließlich Nicht-Typhus-Stämme) und Bacillus Calmette-Guerin (BCG)-Impfstoffe.
- Patienten mit aktiver Tuberkulose sollte Ustekinumab nicht verabreicht werden. Vor der biologischen Behandlung sollten Röntgenaufnahmen des Brustkorbs, indirekte Mantoux-Tests und/oder QuantiFERON Gold durchgeführt werden. Erwägen Sie bei Patienten mit latenter oder aktiver Tuberkulose in der Vorgeschichte eine Behandlung gegen Tuberkulose, bevor Sie mit Ustekinumab beginnen. Patienten, die Ustekinumab erhalten, sollten während und nach der Behandlung engmaschig auf Anzeichen und Symptome einer aktiven Tuberkulose überwacht werden.
Impfstoffe und Ustekinumab
Der Impfstatus sollte vor Beginn der Behandlung mit Ustekinumab überprüft werden. Bei Bedarf sollten die Impfstoffe vor der Behandlung mit einem biologischen Wirkstoff aktualisiert werden. Eine jährliche Grippeimpfung wird empfohlen.
Da sie bei immungeschwächten Personen Krankheiten auslösen können, sollten Lebendimpfstoffe während der Behandlung mit Ustekinumab nicht verwendet werden. Derzeit sind abgeschwächte Viruslebendimpfstoffe verfügbar, darunter Masern, Mumps, Röteln, Windpocken und Gelbfieber Fieber, Influenza (intranasaler Impfstoff) und der orale Polio-Impfstoff. Zu den abgeschwächten Lebendimpfstoffen gehören BCG und der orale Typhusimpfstoff.
Lesen Sie mehr über die Immunisierung unter immunsupprimiert Dermatologie Patienten.
Wechselwirkungen mit Ustekinumab
- Mit Ustekinumab wurden keine formellen Arzneimittelwechselwirkungsstudien durchgeführt.
- Die Sicherheit von Ustekinumab in Kombination mit Immunsuppressivum Wirkstoffe oder Phototherapie wurden nicht untersucht.
Verwendung von Ustekinumab in bestimmten Populationen
Schwangerschaftskategorie B
Es liegen keine Studien zu Ustekinumab bei schwangeren Frauen vor. Ustekinumab sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter
Vorsicht ist geboten, wenn einer stillenden Frau Ustekinumab verabreicht wird. Unbekannte Risiken für den Säugling von Magen-Darm- oder systemisch Die Exposition gegenüber Ustekinumab sollte mit den bekannten Vorteilen des Stillens verglichen werden.
Pädiatrisch verwenden
Eine Studie hat gezeigt, dass die Sicherheit und Wirksamkeit von Ustekinumab bei Kindern im Alter von 12 bis 17 Jahren ähnlich ist wie bei Erwachsenen.
Hepatisch und Nieren- Behinderung
Nein pharmakokinetisch Es liegen Daten zu Patienten mit Leber- oder Nierenerkrankungen vor, die mit Ustekinumab behandelt wurden.
Überwachung während der Einnahme von Ustekinumab
Es wird empfohlen, dass Patienten, die biologische Medikamente einnehmen, etwa alle sechs Monate routinemäßige Blutuntersuchungen durchführen lassen, einschließlich eines großen Blutbildes und Leberfunktionstests. Tuberkulosetests sollten von Zeit zu Zeit wiederholt werden.