¿Qué es ustekinumab?
Ustekinumab (nombre comercial STELARA ™) es un tratamiento biológico que se usa para tratar la psoriasis moderada a grave. Es un humano monoclonal anticuerpo que antagoniza interleucina-12 (IL-12) e IL-23. Se observan respuestas de buenas a excelentes en más de dos tercios de los pacientes con crónico placa psoriasis tratada con ustekinumab.
Ustekinumab ha demostrado en pequeños estudios que es útil en otras formas de psoriasis, incluyendo uña psoriasis, psoriasis eritrodérmica, generalizado pustuloso psoriasis y palmoplantar pustulosis. También se utiliza para tratar la psoriasis. artritis y enfermedad de Crohn.
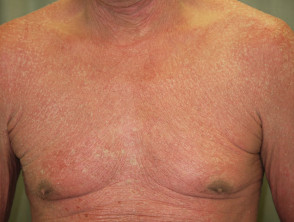
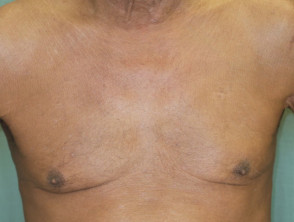
Psoriasis eritrodérmica antes y 2 semanas después de una dosis única de ustekinumab
Psoriasis eritrodérmica antes de ustekinumab
Psoriasis eritrodérmica 2 semanas después de la primera dosis de ustekinumab
¿Cómo actúa ustekinumab en la psoriasis?
La psoriasis es causada por un aumento en la producción de Células T y está influenciado por citocinas, los mensajeros químicos producidos por las células. Ciertas citocinas hacen que las células de la piel crezcan rápidamente, produciendo placas de la psoriasis. Ustekinumab es un anticuerpo monoclonal que se dirige a la subunidad p40 de las citocinas IL-12 e IL-23, evitando que se unan y activen T-linfocitos.
Dosificación de ustekinumab
Ustekinumab es administrado por subcutáneo inyección. La segunda dosis se administra 4 semanas después de la primera inyección y las dosis adicionales se administran cada 12 semanas. Alcanza su efecto máximo alrededor de las 28 semanas.
- La dosis para pacientes que pesen menos de 100 kg es de 45 mg.
- La dosis para pacientes que pesen más de 100 kg es de 90 mg.
- Cada inyección se administra mejor en un lugar diferente (como la parte superior de los brazos, las nalgas, los muslos o el abdomen)
Eventos adversos debido a ustekinumab
Hasta la fecha, adverso infecciones son consistentes con lo visto con otros biológicos.
- Infecciones: ustekinumab puede aumentar el riesgo de infecciones y reactivación de latente Infecciones Grave bacteriano, se han observado infecciones fúngicas y virales en sujetos que reciben el fármaco.
- Neoplasias malignas: ustekinumab es un inmunosupresor y puede aumentar el riesgo de malignidad (cáncer) incluidos los cánceres de piel.
- Se han notificado trastornos del sistema inmunológico durante el uso posterior a la aprobación con ustekinumab. Estos han incluido graves reacciones alérgicas (incluso angioedema, dificultad para respirar y presión arterial baja) y hipersensibilidad (alergia) reacciones (incluyendo erupción y urticaria).
- Las reacciones en el lugar de la inyección incluyen dolor, hinchazón, picazón, engrosamiento, sangrado y hematomas.
Precauciones al considerar ustekinumab
- Crónico infección o una historia de recurrente infección. Ustekinumab no debe administrarse hasta que la infección se resuelva o se trate de manera adecuada.
- Los pacientes tratados con ustekinumab pueden ser susceptible a la infección (incluida la tuberculosis, atípico micobacterias), salmonela (incluidas las cepas no tifoideas) y vacunas contra el Bacillus Calmette-Guerin (BCG).
- Ustekinumab no debe administrarse a pacientes con tuberculosis activa. Antes del tratamiento biológico, se deben realizar radiografías de tórax, pruebas indirectas de Mantoux y / o QuantiFERON gold. Considere el tratamiento antituberculoso antes de iniciar ustekinumab en pacientes con antecedentes de tuberculosis latente o activa. Los pacientes que reciben ustekinumab deben ser monitoreados de cerca para detectar signos y síntomas de tuberculosis activa durante y después del tratamiento.
Vacunas y ustekinumab
Se debe revisar el estado de inmunización antes de comenzar con ustekinumab. Si es necesario, las vacunas deben actualizarse antes del tratamiento con un agente biológico. Se recomienda la vacunación anual contra la influenza.
Como pueden inducir enfermedades en individuos inmunodeficientes, no se deben utilizar vacunas vivas durante el tratamiento con ustekinumab. Actualmente, las vacunas virales vivas atenuadas disponibles incluyen sarampión, paperas, rubéola, varicela, amarillo fiebre, influenza (vacuna intranasal) y la vacuna oral contra la polio. Las vacunas bacterianas vivas atenuadas incluyen BCG y la vacuna oral contra la fiebre tifoidea.
Leer más sobre inmunización en inmunosuprimido dermatología pacientes.
Interacciones farmacológicas con ustekinumab
- No se han realizado estudios formales de interacciones medicamentosas con ustekinumab.
- La seguridad de ustekinumab en combinación con inmunosupresor agentes o fototerapia no se ha evaluado.
Uso de ustekinumab en poblaciones específicas
Categoría B de embarazo
No hay estudios de ustekinumab en mujeres embarazadas. Ustekinumab debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes
Se debe tener precaución cuando se administre ustekinumab a una mujer lactante. Los riesgos desconocidos para el lactante de origen gastrointestinal o sistémico La exposición a ustekinumab debe compararse con los beneficios conocidos de la lactancia materna.
Pediátrico utilizar
Un estudio ha demostrado que la seguridad y eficacia de ustekinumab en niños de 12 a 17 años es similar a la de los adultos.
Hepático y renal discapacidad
No farmacocinético Hay datos disponibles en pacientes con enfermedad hepática o renal tratados con ustekinumab.
Monitoreo mientras toma ustekinumab
Se recomienda que los pacientes que toman medicamentos biológicos se realicen análisis de sangre de rutina cada 6 meses aproximadamente, incluidos hemogramas completos y pruebas de función hepática. Las pruebas de tuberculosis deben repetirse de vez en cuando.