Einführung
Im Juli 2015 genehmigte die US-amerikanische Food and Drug Administration Sonidegib (Odomzo)®;; Novartis, NJ, USA) Zur Behandlung von erwachsenen Patienten mit basal Zelle Karzinom (BCC).
Die Europäische Kommission hat im August 2015 die Anwendung von Sonidegib bei Basalzellkarzinomen genehmigt. Im Juni 2016 wurde Sonidegib in der Schweiz die Genehmigung für das Inverkehrbringen zur Behandlung von Erwachsenen mit fortgeschrittenem Basalzellkarzinom erteilt. Das Medikament ist auch in Australien zugelassen. Gesundheitsbehörden auf der ganzen Welt prüfen derzeit weitere Zulassungsanträge.
Wofür wird Sonidegib angewendet?
Sonidegib ist zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem Basalzellkarzinom indiziert, das nach der Operation oder erneut aufgetreten ist Strahlentherapieoder diejenigen, die keine Kandidaten für eine Operation oder Strahlentherapie sind.
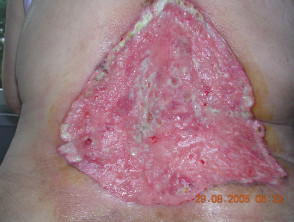
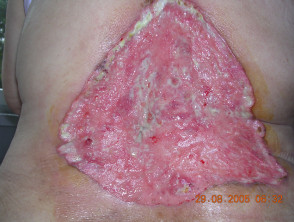
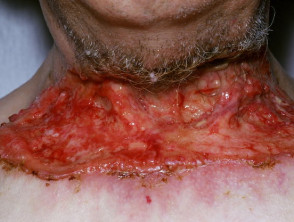
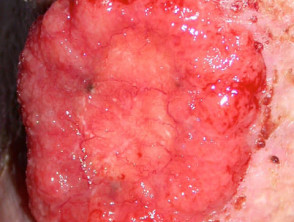
Fortgeschrittenes Basalzellkarzinom
Fortgeschrittenes BCC
Fortgeschrittenes Basalzellkarzinom
Fortgeschrittenes Basalzellkarzinom
Wie funktioniert Sonidegib?
- Sonidegib ist ein Inhibitor der Igelstraße.
- Bindet und hemmt Smoothened, eine Transmembran Protein beteiligt sich an der Hedgehog-Signalübertragung, die eine entscheidende Rolle bei der Aufrechterhaltung der Stammzellen und der Gewebereparatur spielt.
Sonidegib Dosierung und Verabreichung
- Sonidegib wird oral verabreicht.
- Es ist als undurchsichtige rosa Kapsel erhältlich.
- Die empfohlene Dosis beträgt 200 mg einmal täglich auf leeren Magen, mindestens 1 Stunde vor oder 2 Stunden nach einer Mahlzeit, verabreicht bis zum Fortschreiten der Krankheit oder inakzeptabel. Toxizität.
- Stellen Sie vor Beginn der Behandlung mit Sonidegib sicher, dass die Patientin nicht schwanger ist.
- Sonidegib kann bei Verabreichung an eine schwangere Frau zum Tod des Embryos oder zu schweren Geburtsfehlern führen.
- Frauen im gebärfähigen Alter sollten angewiesen werden, während der Behandlung mit Sonidegib und mindestens 20 Monate nach der letzten Dosis eine wirksame Verhütungsmethode anzuwenden.
- Bei allen Patienten Serum Aufgrund des Potenzials sollten die Kreatinkinase (CK) -Werte vor Beginn der Sonidegib-Behandlung überprüft werden Bewegungsapparat Nebenwirkungen.
- Das Medikament sollte dauerhaft abgesetzt werden, wenn die Erhöhung der Serum-CK bei Verschlechterung mehr als das 2,5-fache der Obergrenze des Normalwerts beträgt. Nieren- Funktion.
- Die Sonidegib-Dosis sollte bei schweren Erkrankungen des Bewegungsapparates geändert werden. Nebenwirkungen.
- Wenn eine Sonidegib-Dosis versäumt wird, sollte sie mit der nächsten geplanten Dosis fortgesetzt werden.
Link zu wichtigen Erkenntnissen aus klinischen Studien mit Sonidegib
Mögliche Wechselwirkungen mit Sonidegib
- Sonidegib wird hauptsächlich von metabolisiert hepatisch Enzyme CYP3A (Familie von Cytochrom P450-Oxidationsenzymen).
- Begleitend Verabreichung von Sonidegib mit starkem und mäßigem CYP3A InhibitorenDaher sollten Saquinavir, Telithromycin, Ketoconazol, Itraconazol, Voriconazol, Posaconazol, Nefazodon, Diltiazem, Atazanavir und Fluconazol vermieden werden.
- Die gleichzeitige Anwendung von Sonidegib mit starken und moderaten CYP3A-Induktoren, einschließlich Carbamazepin, Efavirenz, Modafinil, Phenobarbital, Phenytoin, Rifabutin, Rifampin und Johanniskraut, sollte ebenfalls vermieden werden.
Was sind die Nebenwirkungen von Sonidegib?
Die häufigsten Nebenwirkungen (≥10%) im Zusammenhang mit der Behandlung mit Sonidegib in klinischen Studien waren:
- Muskelkrämpfe
- Alopezie
- Dysgeusie (abnormaler Geschmack)
- ermüden
- Übelkeit
- muskuloskelettale Schmerzen
- Durchfall
- Gewichtsverlust
- verminderter Appetit
- Myalgie (Muskelschmerzen)
- Bauchschmerzen
- Kopfschmerzen
- sich übergeben
- Juckreiz
Warnungen und Vorsichtsmaßnahmen
- In Tierreproduktionsstudien war Sonidegib embryotoxisch, foetotoxisch und teratogen bei Expositionen der Mutter unter der empfohlenen menschlichen Dosis von 200 mg.
- Sonidegib kann bei Verabreichung an eine schwangere Frau zum Tod des Embryos oder zu schweren Geburtsfehlern führen.
- Die Patienten müssen während der Behandlung mit Sonidegib und mindestens 20 Monate nach der letzten Dosis eine wirksame Verhütungsmethode anwenden.
- Männlichen Patienten mit weiblichen Partnern sollte geraten werden, Kondome zu verwenden, auch nach einer Vasektomie, während der Behandlung mit Sonidegib und mindestens 8 Monate nach der letzten Dosis, um eine mögliche Arzneimittelexposition bei Frauen im schwangeren oder reproduktiven Alter zu vermeiden. .
- Patienten sollten angewiesen werden, während der Einnahme von Sonidegib und mindestens 20 Monate nach der letzten Sonidegib-Dosis kein Blut oder Blutprodukte zu spenden, da ihr Blut oder ihre Blutprodukte einer Frau mit reproduktivem Potenzial verabreicht werden können.
- Bei Sonidegib und anderen Arzneimitteln können muskuloskelettale Nebenwirkungen auftreten, die mit einem Anstieg der Serumkreatinkinase (CK) einhergehen hemmen der Weg des Igels.
- Base Die Serumkreatinin- und CK-Spiegel sollten vor Beginn der Behandlung mit Sonidegib gemessen werden.
- Serumkreatinin- und CK-Spiegel sollten bei Patienten mit muskuloskelettalen Nebenwirkungen mit mindestens wöchentlich gemessen werden gleichzeitig Erhöhung der Serum-CK über das 2,5-fache der Obergrenze des Normalwerts bis zur Auflösung der klinischen Anzeichen und Symptome.
- Die Dosierung muss möglicherweise aufgrund von muskuloskelettalen Nebenwirkungen oder erhöhtem Serum-CK unterbrochen oder vorübergehend ausgesetzt werden.
Anwendung von Sonidegib während der Schwangerschaft
- Es liegen keine Daten zur Anwendung von Sonidegib bei schwangeren Frauen vor.
- Daten aus Tierreproduktionsstudien zeigen, dass Sonidegib bei Verabreichung an eine schwangere Frau fetale Schäden verursachen kann.
Anwendung von Sonidegib bei stillenden Müttern
- Es liegen keine Daten zum Vorhandensein von Sonidegib in der Muttermilch, zu den Auswirkungen des Arzneimittels auf das stillende Kind oder zu den Auswirkungen des Arzneimittels auf die Milchproduktion vor.
- Frauen sollten angewiesen werden, das Stillen während der Behandlung und für 20 Monate nach der letzten Dosis abzubrechen.
Pädiatrisch Verwendung von Sonidegib
Die Sicherheit und Wirksamkeit von Sonidegib bei Kindern wurde nicht nachgewiesen (<18 años).
Geriatrische Anwendung von Sonidegib
- In klinischen Studien mit Sonidegib waren 54% der Patienten 65 Jahre oder älter und 28% 75 Jahre oder älter.
- Es wurden keine allgemeinen Unterschiede in der Wirksamkeit zwischen diesen Patienten und den jüngeren Patienten beobachtet.
- Es gab jedoch eine größere Vorfall Ernsthaft Nebenwirkungen Unterbrechen oder Aussetzen der Dosis bei Patienten ≥ 65 Jahren im Vergleich zu jüngeren Patienten.
Leberversagen und Sonidegib
- Mild (Child-Pugh-Klasse A; Child-Pugh-Klassifizierung wird zur Beurteilung verwendet Prognose von chronisch Lebererkrankung), mittelschwere (Child-Pugh-Klasse B) oder schwere (Child-Pugh-Klasse C) Leberfunktionsstörungen hatten im Vergleich zu Probanden mit normaler Leberfunktion keinen klinisch signifikanten Einfluss auf die Sonidegib-Exposition.
Nierenversagen und Sonidegib
- In klinischen Studien hatten eine leichte Nierenfunktionsstörung (Kreatinin-Clearance 60 bis 89 ml / min) und eine moderate Nierenfunktionsstörung (Kreatinin-Clearance 30 bis 59 ml / min) keinen Einfluss auf die Exposition von Sonidegib im Steady-State. im Vergleich zu Patienten mit normaler Nierenfunktion (Ccr ≥ 90 ml / min).
Einfluss von Sonidegib auf das Alter, Sex, Gewicht und Rasse
- Alter, Körpergewicht oder Geschlecht hatten keinen klinisch signifikanten Einfluss auf die Sonidegib-Exposition im Steady-State.
- Ein Vergleich von Crossover-Studien hat ergeben, dass die Geometrie halb AUCinf (Bereich unter dem Plasma Die Konzentration gegenüber der Zeitkurve von Null bis unendlich) von Sonidegib ist bei gesunden japanischen Probanden nach einer Einzeldosis von 200 mg 1,7-mal höher als bei gesunden westlichen Probanden (schwarz und weiß).