Introducción
En julio de 2015, la FDA (Administración de Drogas y Alimentos) de EE. UU. Aprobó el sonidegib (Odomzo®; Novartis, Nueva Jersey, EE. UU.) Para el tratamiento de pacientes adultos con basal célula carcinoma (BCC).
La Comisión Europea aprobó el uso de sonidegib para el carcinoma de células basales en agosto de 2015. En junio de 2016, se concedió la autorización de comercialización de sonidegib en Suiza para el tratamiento de adultos con carcinoma de células basales avanzado. La droga también está aprobada en Australia. Las autoridades sanitarias de todo el mundo están revisando presentaciones reglamentarias adicionales.
¿Para qué se utiliza sonidegib?
Sonidegib está indicado para el tratamiento de pacientes adultos con carcinoma de células basales localmente avanzado que ha recurrido después de una cirugía o radioterapia, o aquellos que no son candidatos para cirugía o radioterapia.
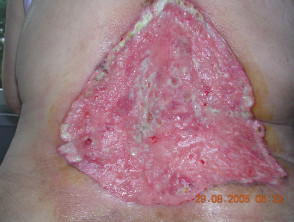
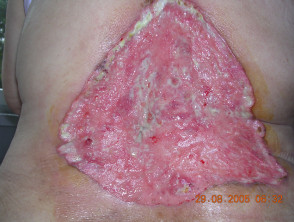
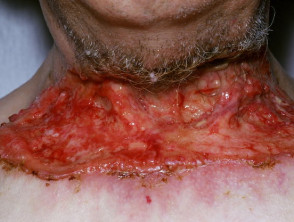
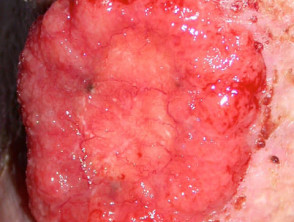
Carcinoma de células basales avanzado
BCC avanzado
Carcinoma de células basales avanzado
Carcinoma de células basales avanzado
¿Cómo actúa sonidegib?
- Sonidegib es un inhibidor de la vía Hedgehog.
- Se une e inhibe Smoothened, una transmembrana proteína participa en la transducción de señales Hedgehog, que juega un papel fundamental en el mantenimiento de las células madre y la reparación de tejidos.
Posología y administración de sonidegib
- Sonidegib se administra por vía oral.
- Está disponible como una cápsula de color rosa opaco.
- La dosis recomendada es de 200 mg una vez al día con el estómago vacío, al menos 1 hora antes o 2 horas después de una comida, administrada hasta la progresión de la enfermedad o inaceptable. toxicidad.
- Antes de iniciar el tratamiento con sonidegib, asegúrese de que la paciente no esté embarazada.
- Sonidegib puede causar muerte embriofetal o defectos de nacimiento graves cuando se administra a una mujer embarazada.
- Se debe aconsejar a las mujeres en edad fértil que utilicen métodos anticonceptivos eficaces durante el tratamiento con sonidegib y durante al menos 20 meses después de la última dosis.
- En todos los pacientes, suero Los niveles de creatina quinasa (CK) deben llevarse a cabo antes de iniciar sonidegib debido al potencial musculoesquelético efectos adversos.
- El fármaco debe suspenderse permanentemente si la elevación de la CK sérica es superior a 2,5 veces el límite superior normal con empeoramiento. renal función.
- La dosis de sonidegib debe modificarse en caso de enfermedad musculoesquelética grave. Reacciones adversas.
- Si se olvida una dosis de sonidegib, se debe reanudar la administración con la siguiente dosis programada.
Enlace a evidencia clave de ensayos clínicos sobre sonidegib
Posibles interacciones farmacológicas con sonidegib
- Sonidegib se metaboliza principalmente por hepático enzimas CYP3A (familia de enzimas oxidantes del citocromo P450).
- Concomitante administración de sonidegib con CYP3A fuerte y moderado inhibidores, incluidos saquinavir, telitromicina, ketoconazol, itraconazol, voriconazol, posaconazol, nefazodona, diltiazem, atazanavir y fluconazol, por lo tanto, deben evitarse.
- También debe evitarse la administración concomitante de sonidegib con inductores potentes y moderados de CYP3A, incluidos carbamazepina, efavirenz, modafinilo, fenobarbital, fenitoína, rifabutina, rifampicina y hierba de San Juan.
¿Cuáles son los efectos adversos del sonidegib?
Las reacciones adversas más frecuentes (≥ 10%) asociadas con el tratamiento con sonidegib en los ensayos clínicos fueron:
- espasmos musculares
- alopecia
- disgeusia (sabor anormal)
- fatiga
- náusea
- dolor musculoesquelético
- Diarrea
- disminución de peso
- disminucion del apetito
- mialgia (dolores musculares)
- dolor abdominal
- dolor de cabeza
- vomitando
- prurito
Advertencias y precauciones
- En estudios de reproducción animal, sonidegib fue embriotóxico, fetotóxico y teratogénico a exposiciones maternas inferiores a la dosis humana recomendada de 200 mg.
- Sonidegib puede causar muerte embriofetal o defectos de nacimiento graves cuando se administra a una mujer embarazada.
- Las pacientes deben utilizar métodos anticonceptivos eficaces durante el tratamiento con sonidegib y durante al menos 20 meses después de la última dosis.
- Se debe aconsejar a los pacientes varones con parejas femeninas que utilicen condones, incluso después de una vasectomía, durante el tratamiento con sonidegib y durante al menos 8 meses después de la última dosis para evitar la exposición potencial al fármaco en mujeres embarazadas o en edad reproductiva.
- Se debe advertir a los pacientes que no donen sangre o hemoderivados mientras estén tomando sonidegib y durante al menos 20 meses después de la última dosis de sonidegib porque su sangre o hemoderivados pueden ser administrados a una mujer con potencial reproductivo.
- Pueden producirse reacciones adversas musculoesqueléticas, acompañadas de elevaciones de la creatincinasa sérica (CK), con sonidegib y otros fármacos que inhibir la vía del erizo.
- Base Se deben medir los niveles séricos de creatinina y CK antes de iniciar el tratamiento con sonidegib.
- Los niveles séricos de creatinina y CK deben medirse al menos semanalmente en pacientes con reacciones adversas musculoesqueléticas con concurrente elevación de la CK sérica superior a 2,5 veces el límite superior de lo normal, hasta la resolución de los signos y síntomas clínicos.
- Es posible que sea necesario interrumpir o suspender temporalmente la dosis ante reacciones adversas musculoesqueléticas o elevación de la CK sérica.
Uso de sonidegib durante el embarazo
- No hay datos disponibles sobre el uso de sonidegib en mujeres embarazadas.
- Los datos de estudios de reproducción animal indican que sonidegib puede causar daño fetal cuando se administra a una mujer embarazada.
Uso de sonidegib en madres lactantes
- No se dispone de datos sobre la presencia de sonidegib en la leche materna, los efectos del fármaco en el lactante o los efectos del fármaco en la producción de leche.
- Se debe advertir a las mujeres que suspendan la lactancia durante el tratamiento y durante 20 meses después de la última dosis.
Pediátrico uso de sonidegib
No se ha establecido la seguridad y eficacia de sonidegib en niños (<18 años).
Uso geriátrico de sonidegib
- En los ensayos clínicos con sonidegib, el 54% de los pacientes tenían 65 años o más y el 28% tenían 75 años o más.
- No se observaron diferencias generales en la eficacia entre estos pacientes y los pacientes más jóvenes.
- Sin embargo, hubo una mayor incidencia de serio eventos adversos requiriendo la interrupción o suspensión de la dosis en pacientes ≥65 años, en comparación con pacientes más jóvenes.
Insuficiencia hepática y sonidegib
- Leve (clase A de Child-Pugh; la clasificación de Child-Pugh se utiliza para evaluar la pronóstico de crónico enfermedad hepática), la insuficiencia hepática moderada (clase B de Child-Pugh) o grave (clase C de Child-Pugh) no tuvo un efecto clínicamente significativo sobre la exposición a sonidegib en comparación con sujetos con función hepática normal.
Insuficiencia renal y sonidegib
- En los ensayos clínicos, la insuficiencia renal leve (aclaramiento de creatinina de 60 a 89 ml / min) y la insuficiencia renal moderada (aclaramiento de creatinina de 30 a 59 ml / min) no tuvieron ningún efecto sobre la exposición en estado estacionario de sonidegib en comparación con los pacientes con función renal normal (Ccr ≥ 90 ml / min).
Efecto de sonidegib sobre la edad, sexo, peso y raza
- La edad, el peso corporal o el sexo no tuvieron un efecto clínicamente significativo sobre la exposición a sonidegib en estado estable.
- Una comparación de estudios cruzados ha sugerido que la geometría media AUCinf (área debajo del plasma concentración versus curva de tiempo de cero a infinito) de sonidegib es 1,7 veces mayor en sujetos sanos japoneses en comparación con sujetos sanos occidentales (blancos y negros) después de una dosis única de 200 mg.