Invoering
In juli 2015 keurde de Amerikaanse FDA (Food and Drug Administration) sonidegib (Odomzo®; Novartis, New Jersey, VS) voor de behandeling van volwassen patiënten met basaal cel carcinoom (BCC).
De Europese Commissie keurde het gebruik van sonidegib voor basaalcelcarcinoom goed in augustus 2015. In juni 2016 werd in Zwitserland een handelsvergunning verleend voor sonidegib voor de behandeling van volwassenen met gevorderd basaalcelcarcinoom. Het medicijn is ook goedgekeurd in Australië. Gezondheidsautoriteiten over de hele wereld beoordelen aanvullende ingediende regelgeving.
Waar wordt sonidegib voor gebruikt?
Sonidegib is geïndiceerd voor de behandeling van volwassen patiënten met lokaal gevorderd basaalcelcarcinoom dat is teruggekeerd na een operatie of radiotherapie, of degenen die geen kandidaat zijn voor een operatie of radiotherapie.
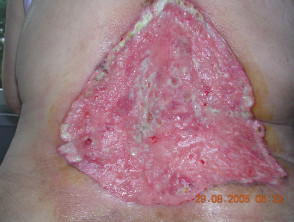
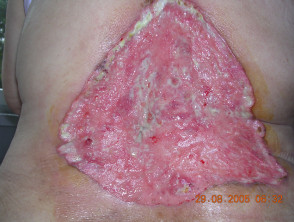
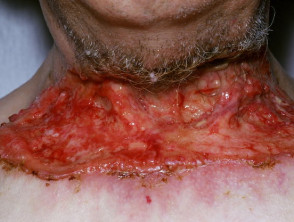
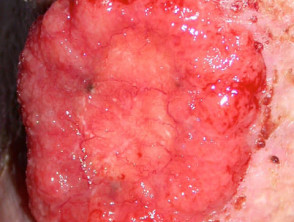
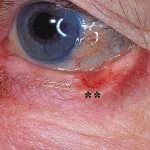
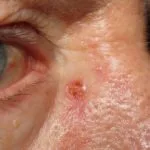
Gevorderd basaalcelcarcinoom
geavanceerde CCB
Gevorderd basaalcelcarcinoom
Gevorderd basaalcelcarcinoom
Hoe werkt sonidegib?
- Sonidegib is een remmer van Hedgehog Way.
- Bindt aan en remt Smoothened, een transmembraan eiwit neemt deel aan Hedgehog-signaaltransductie, die een cruciale rol speelt bij het onderhoud van stamcellen en weefselherstel.
Dosering en toediening van sonidegib
- Sonidegib wordt oraal toegediend.
- Het is verkrijgbaar als een ondoorzichtige roze capsule.
- De aanbevolen dosis is 200 mg eenmaal daags op een lege maag, minstens 1 uur voor of 2 uur na een maaltijd, toegediend tot ziekteprogressie of onaanvaardbaar. toxiciteit.
- Zorg ervoor dat de patiënt niet zwanger is voordat de behandeling met sonidegib wordt gestart.
- Sonidegib kan embryofoetale sterfte of ernstige geboorteafwijkingen veroorzaken wanneer het wordt toegediend aan een zwangere vrouw.
- Vrouwen in de vruchtbare leeftijd moeten worden geadviseerd effectieve anticonceptie te gebruiken tijdens de behandeling met sonidegib en gedurende ten minste 20 maanden na de laatste dosis.
- Bij alle patiënten serum Vanwege het potentieel moeten creatinekinase (CK)-spiegels worden bepaald voordat met sonidegib wordt begonnen bewegingsapparaat Bijwerkingen.
- Het medicijn moet permanent worden stopgezet als de serum-CK-verhoging groter is dan 2,5 keer de bovengrens van normaal met verslechtering. nier functie.
- De dosis sonidegib moet worden aangepast in geval van ernstige musculoskeletale aandoeningen. Bijwerkingen.
- Als een dosis sonidegib wordt gemist, moet de dosering worden hervat met de volgende geplande dosis.
Link naar belangrijk bewijs uit klinische onderzoeken met sonidegib
Potentiële geneesmiddelinteracties met sonidegib
- Sonidegib wordt voornamelijk gemetaboliseerd door lever enzymen CYP3A (cytochroom P450-familie van oxiderende enzymen).
- Gelijktijdig toediening van sonidegib met sterke en matige CYP3A remmers, inclusief saquinavir, telitromycine, ketoconazol, itraconazol, voriconazol, posaconazol, nefazodon, diltiazem, atazanavir en fluconazol moeten daarom worden vermeden.
- Gelijktijdige toediening van sonidegib met sterke en matige inductoren van CYP3A, waaronder carbamazepine, efavirenz, modafinil, fenobarbital, fenytoïne, rifabutine, rifampicine en sint-janskruid, moet ook worden vermeden.
Wat zijn de bijwerkingen van sonidegib?
De meest voorkomende bijwerkingen (≥ 10%) geassocieerd met behandeling met sonidegib in klinische studies waren:
- spiertrekkingen
- alopecia
- dysgeusie (abnormale smaak)
- vermoeidheid
- misselijkheid
- musculoskeletale pijn
- Diarree
- gewichtsverlies
- verminderde eetlust
- spierpijn (spierpijn)
- buikpijn
- hoofdpijn
- overgeven
- jeuk
Waarschuwingen en voorzorgsmaatregelen
- In voortplantingsstudies bij dieren was sonidegib embryotoxisch, foetotoxisch en teratogeen bij maternale blootstellingen onder de aanbevolen dosis voor de mens van 200 mg.
- Sonidegib kan embryofoetale sterfte of ernstige geboorteafwijkingen veroorzaken wanneer het wordt toegediend aan een zwangere vrouw.
- Patiënten moeten effectieve anticonceptie gebruiken tijdens de behandeling met sonidegib en gedurende ten minste 20 maanden na de laatste dosis.
- Mannelijke patiënten met vrouwelijke partners moeten worden geadviseerd condooms te gebruiken, ook na vasectomie, tijdens de behandeling met sonidegib en gedurende ten minste 8 maanden na de laatste dosis om mogelijke blootstelling aan het geneesmiddel bij zwangere vrouwen of vrouwen in de vruchtbare leeftijd te voorkomen.
- Patiënten moeten worden gewaarschuwd geen bloed of bloedproducten te doneren tijdens het gebruik van sonidegib en gedurende ten minste 20 maanden na de laatste dosis sonidegib, omdat hun bloed of bloedproducten kunnen worden toegediend aan een vruchtbare vrouw.
- Musculoskeletale bijwerkingen, vergezeld van verhogingen van serumcreatinekinase (CK), kunnen optreden bij sonidegib en andere geneesmiddelen die verbieden de weg van de egel
- Baseren Serumcreatinine- en CK-spiegels moeten worden gemeten voordat behandeling met sonidegib wordt gestart.
- Serumcreatinine- en CK-spiegels moeten ten minste wekelijks worden gemeten bij patiënten met musculoskeletale bijwerkingen met gelijktijdig verhoging van de serum-CK van meer dan 2,5 maal de bovengrens van normaal, totdat de klinische tekenen en symptomen verdwenen zijn.
- Dosisonderbreking of tijdelijke stopzetting kan nodig zijn voor musculoskeletale bijwerkingen of verhoging van serum-CK.
Gebruik van sonidegib tijdens de zwangerschap
- Er zijn geen gegevens beschikbaar over het gebruik van sonidegib bij zwangere vrouwen.
- Gegevens uit voortplantingsstudies bij dieren geven aan dat sonidegib schade aan de foetus kan toebrengen wanneer het wordt toegediend aan een zwangere vrouw.
Gebruik van sonidegib bij zogende moeders
- Er zijn geen gegevens beschikbaar over de aanwezigheid van sonidegib in de moedermelk, de effecten van het geneesmiddel op de zuigeling of de effecten van het geneesmiddel op de melkproductie.
- Vrouwen moeten worden geadviseerd om de borstvoeding te staken tijdens de behandeling en gedurende 20 maanden na de laatste dosis.
pediatrisch gebruik van sonidegib
De veiligheid en werkzaamheid van sonidegib bij kinderen zijn niet vastgesteld (<18 años).
Geriatrisch gebruik van sonidegib
- In klinische onderzoeken met sonidegib was 54% van de patiënten 65 jaar of ouder en 28% 75 jaar of ouder.
- Er werden geen algemene verschillen in werkzaamheid waargenomen tussen deze patiënten en jongere patiënten.
- Er was echter een grotere incidentie ernstig bijwerkingen waarvoor dosisonderbreking of -stopzetting nodig is bij patiënten ≥65 jaar, in vergelijking met jongere patiënten.
Leverfalen en sonidegib
- Mild (Child-Pugh-klasse A; de Child-Pugh-classificatie wordt gebruikt om de voorspelling van chronisch leverziekte), matige (Child-Pugh-klasse B) of ernstige (Child-Pugh-klasse C) leverfunctiestoornis had geen klinisch significant effect op de blootstelling aan sonidegib in vergelijking met proefpersonen met een normale leverfunctie.
Nierfalen en sonidegib
- In klinische onderzoeken hadden milde nierinsufficiëntie (creatinineklaring 60 tot 89 ml/min) en matige nierinsufficiëntie (creatinineklaring 30 tot 59 ml/min) geen effect op de steady-state blootstelling aan sonidegib in vergelijking met patiënten met een normale nierfunctie. (Ccr ≥ 90 ml/min).
Effect van sonidegib op leeftijd, seks, gewicht en ras
- Leeftijd, lichaamsgewicht of geslacht hadden geen klinisch significant effect op de steady-state blootstelling aan sonidegib.
- Een cross-studie vergelijking heeft gesuggereerd dat geometrie voor de helft AUCinf (gebied onder de plasma concentratie-versus-tijdcurve van nul tot oneindig) van sonidegib is 1,7 keer hoger bij gezonde Japanse proefpersonen in vergelijking met gezonde westerse (blanke en zwarte) proefpersonen na een enkele dosis van 200 mg.