introduzione
Nel luglio 2015, la FDA (Food and Drug Administration) statunitense ha approvato sonidegib (Odomzo®; Novartis, New Jersey, USA) per il trattamento di pazienti adulti con basale cellula carcinoma (BCC).
La Commissione Europea ha approvato l’uso di sonidegib per il carcinoma basocellulare nell’agosto 2015. Nel giugno 2016 è stata concessa l’autorizzazione all’immissione in commercio per sonidegib in Svizzera per il trattamento degli adulti affetti da carcinoma basocellulare avanzato. Il farmaco è approvato anche in Australia. Le autorità sanitarie di tutto il mondo stanno esaminando ulteriori proposte normative.
A cosa serve sonidegib?
Sonidegib è indicato per il trattamento di pazienti adulti con carcinoma basocellulare localmente avanzato recidivato dopo intervento chirurgico o radioterapia, o coloro che non sono candidati alla chirurgia o alla radioterapia.
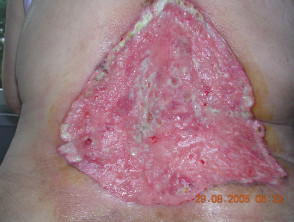
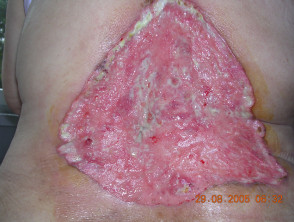
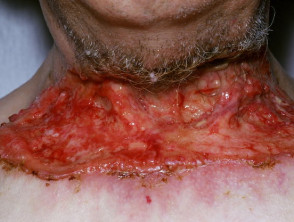
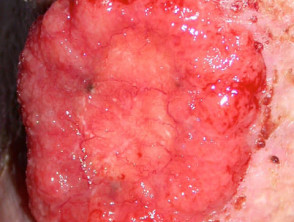
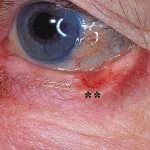
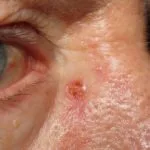
Carcinoma basocellulare avanzato
BCC avanzato
Carcinoma basocellulare avanzato
Carcinoma basocellulare avanzato
Come funziona sonidegib?
- Sonidegib è un inibitore del Sentiero del Riccio.
- Lega e inibisce Smoothened, un transmembrana proteina partecipa alla trasduzione del segnale Hedgehog, che svolge un ruolo fondamentale nel mantenimento delle cellule staminali e nella riparazione dei tessuti.
Dosaggio e somministrazione di sonidegib
- Sonidegib viene somministrato per via orale.
- È disponibile sotto forma di capsula rosa opaca.
- La dose raccomandata è di 200 mg una volta al giorno a stomaco vuoto, almeno 1 ora prima o 2 ore dopo un pasto, somministrata fino alla progressione della malattia o fino al raggiungimento di un livello inaccettabile. tossicità.
- Prima di iniziare il trattamento con sonidegib, assicurarsi che la paziente non sia incinta.
- Sonidegib può causare morte embrio-fetale o gravi difetti congeniti se somministrato a donne in gravidanza.
- Le donne in età fertile devono essere informate di utilizzare un metodo contraccettivo efficace durante il trattamento con sonidegib e per almeno 20 mesi dopo l’ultima dose.
- In tutti i pazienti, siero A causa del potenziale potenziale, i livelli di creatina chinasi (CK) devono essere misurati prima di iniziare sonidegib Muscoloscheletrico Effetti collaterali.
- Il farmaco deve essere sospeso definitivamente se l'aumento della CK sierica è maggiore di 2,5 volte il limite superiore della norma con peggioramento. renale funzione.
- La dose di sonidegib deve essere modificata in caso di grave malattia muscoloscheletrica. Reazioni avverse.
- Se si dimentica una dose di sonidegib, la somministrazione deve essere ripresa con la dose successiva programmata.
Link alle principali evidenze provenienti da studi clinici su sonidegib
Possibili interazioni farmacologiche con sonidegib
- Sonidegib viene metabolizzato principalmente da epatica enzimi CYP3A (famiglia degli enzimi ossidanti il citocromo P450).
- Concomitante somministrazione di sonidegib con CYP3A forte e moderato inibitori, inclusi saquinavir, telitromicina, ketoconazolo, itraconazolo, voriconazolo, posaconazolo, nefazodone, diltiazem, atazanavir e fluconazolo, devono pertanto essere evitati.
- Dovrebbe essere evitata anche la somministrazione concomitante di sonidegib con induttori forti e moderati del CYP3A, inclusi carbamazepina, efavirenz, modafinil, fenobarbital, fenitoina, rifabutina, rifampicina ed erba di San Giovanni.
Quali sono gli effetti avversi di sonidegib?
Le reazioni avverse più comuni (≥ 10%) associate al trattamento con sonidegib negli studi clinici sono state:
- spasmi muscolari
- alopecia
- disgeusia (gusto anomalo)
- fatica
- nausea
- dolore muscoloscheletrico
- Diarrea
- perdita di peso
- diminuzione dell'appetito
- mialgia (dolori muscolari)
- dolore addominale
- mal di testa
- vomitare
- prurito
Avvertenze e precauzioni
- Negli studi sulla riproduzione animale, sonidegib si è rivelato embriotossico, fetotossico e teratogeno ad esposizioni materne inferiori alla dose umana raccomandata di 200 mg.
- Sonidegib può causare morte embrio-fetale o gravi difetti congeniti se somministrato a donne in gravidanza.
- I pazienti devono utilizzare un metodo contraccettivo efficace durante il trattamento con sonidegib e per almeno 20 mesi dopo l'ultima dose.
- Ai pazienti di sesso maschile con partner femminili deve essere consigliato l'uso del preservativo, anche dopo una vasectomia, durante il trattamento con sonidegib e per almeno 8 mesi dopo l'ultima dose per evitare una potenziale esposizione al farmaco nelle donne in gravidanza o in età riproduttiva.
- I pazienti devono essere informati di non donare sangue o emoderivati durante il trattamento con sonidegib e per almeno 20 mesi dopo l’ultima dose di sonidegib poiché il loro sangue o emoderivati potrebbero essere somministrati a una donna potenzialmente riproduttiva.
- Reazioni avverse muscoloscheletriche, accompagnate da aumenti della creatinchinasi sierica (CK), possono verificarsi con sonidegib e altri farmaci che inibire alla maniera del riccio.
- Base I livelli di creatinina sierica e di CK devono essere misurati prima di iniziare il trattamento con sonidegib.
- I livelli di creatinina sierica e di CK devono essere misurati almeno settimanalmente nei pazienti con reazioni avverse muscoloscheletriche simultaneo aumento della CK sierica superiore a 2,5 volte il limite superiore della norma, fino alla risoluzione dei segni e dei sintomi clinici.
- In caso di reazioni avverse muscoloscheletriche o di aumento della CK sierica può essere necessaria l’interruzione della dose o la sospensione temporanea.
Uso di sonidegib durante la gravidanza
- Non sono disponibili dati sull’uso di sonidegib nelle donne in gravidanza.
- I dati provenienti da studi sulla riproduzione animale indicano che sonidegib può causare danni al feto se somministrato a una donna in gravidanza.
Uso di sonidegib nelle madri che allattano
- Non sono disponibili dati sulla presenza di sonidegib nel latte materno, sugli effetti del farmaco sul neonato o sugli effetti del farmaco sulla produzione di latte.
- Si deve consigliare alle donne di interrompere l'allattamento al seno durante il trattamento e per 20 mesi dopo l'ultima dose.
Pediatrico uso di sonidegib
La sicurezza e l’efficacia di sonidegib nei bambini non sono state stabilite (<18 años).
Uso geriatrico di sonidegib
- Negli studi clinici con sonidegib, 541 pazienti TP1T avevano 65 anni o più e 281 pazienti TP1T avevano 75 anni o più.
- Non sono state osservate differenze complessive in termini di efficacia tra questi pazienti e i pazienti più giovani.
- Tuttavia, ce n'era uno maggiore incidenza sul serio eventi avversi che richiedono l’interruzione o la sospensione della dose nei pazienti di età ≥ 65 anni, rispetto ai pazienti più giovani.
Insufficienza epatica e sonidegib
- Lieve (classe Child-Pugh A; la classificazione Child-Pugh viene utilizzata per valutare la previsione di cronica malattia epatica), compromissione epatica moderata (Child-Pugh classe B) o severa (Child-Pugh classe C) non hanno avuto effetti clinicamente significativi sull’esposizione a sonidegib rispetto ai soggetti con funzionalità epatica normale.
Insufficienza renale e sonidegib
- Negli studi clinici, la compromissione renale lieve (clearance della creatinina da 60 a 89 ml/min) e la compromissione renale moderata (clearance della creatinina da 30 a 59 ml/min) non hanno avuto alcun effetto sull’esposizione allo stato stazionario di sonidegib, rispetto ai pazienti con funzionalità renale normale ( Ccr ≥ 90 ml/min).
Effetto di sonidegib sull'età, sesso, peso e razza
- L’età, il peso corporeo o il sesso non hanno avuto effetti clinicamente significativi sull’esposizione a sonidegib allo stato stazionario.
- Un confronto di studi incrociati ha suggerito che la geometria metà AUCinf (area sotto il plasma curva concentrazione-tempo da zero a infinito) di sonidegib è 1,7 volte più elevata nei soggetti sani giapponesi rispetto ai soggetti sani occidentali (bianchi e neri) dopo una singola dose da 200 mg.