Einführung
Im Juli 2015 genehmigte die US-amerikanische Food and Drug Administration Sonidegib (Odomzo)®;; Novartis, NJ, USA) Zur Behandlung von erwachsenen Patienten mit basal Zelle Karzinom (BCC).
Die Europäische Kommission hat im August 2015 die Anwendung von Sonidegib bei Basalzellkarzinomen genehmigt. Im Juni 2016 wurde Sonidegib in der Schweiz die Genehmigung für das Inverkehrbringen zur Behandlung von Erwachsenen mit fortgeschrittenem Basalzellkarzinom erteilt. Das Medikament ist auch in Australien zugelassen, in Neuseeland jedoch noch nicht erhältlich.
Sonidegib ist ein Inhibitor der Igelstraße. Bindet und hemmt Smoothened, eine Transmembran Protein beteiligt sich an der Hedgehog-Signalübertragung, die eine entscheidende Rolle bei der Aufrechterhaltung der Stammzellen und der Gewebereparatur spielt.
Sonidegib ist zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem Basalzellkarzinom (BCC) indiziert, das nach der Operation erneut aufgetreten ist oder Strahlentherapieoder diejenigen, die keine Kandidaten für eine Operation oder Strahlentherapie sind.
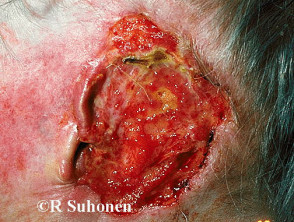
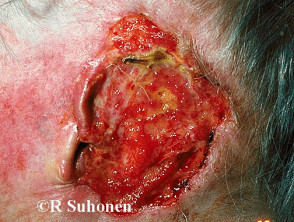
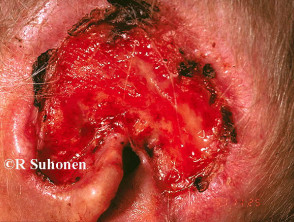
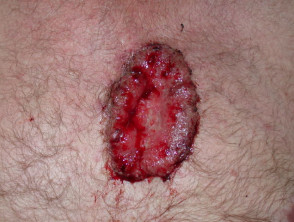
Fortgeschrittenes Basalzellkarzinom
Fortgeschrittenes Basalzellkarzinom
Fortgeschrittenes Basalzellkarzinom
Fortgeschrittenes Basalzellkarzinom
Erfahrung in klinischen Studien mit Sonidegib
- Die FDA-Zulassung basierte auf einer zentralen Phase-II-Studie (BOLT-Studie), a Doppelblind, zufällig, zweiarmige nicht vergleichende Studie bei Patienten mit lokal fortgeschrittenem BCC, die einer lokalen Therapie nicht zugänglich sind oder metastatisch Basalzellkarzinom.
- Die Patienten wurden randomisiert (2: 1) und erhielten einmal täglich 800 mg Sonidigib (n = 151) oder 200 mg (n = 79) oral bis zum Fortschreiten der Krankheit oder einer Unverträglichkeit Toxizität.
- Randomisierung wurde nach Krankheitsstadium (lokal fortgeschritten oder metastasierend), lokal fortgeschrittener BCC-Krankheit geschichtet Histologie (aggressiv versus nicht aggressiv) und geografische Region.
- Patienten mit lokal fortgeschrittenem BCC, die mit 200 mg Sonidegib (n = 66) behandelt wurden, wurden mindestens 12 Monate lang beobachtet, sofern sie nicht früher abgesetzt wurden.
- Die objektive Antwortrate betrug 58% (95%-Konfidenzintervall: 45-70), bestehend aus 5% (n = 3) vollständiger Antworten und 53% (n = 35) Teilantworten.
- Eine vorgegebene Sensitivitätsanalyse unter Verwendung einer alternativen Definition der vollständigen Antwort, definiert als mindestens eine teilweise Antwort basierend auf Magnetresonanz und / oder Foto und ohne Nachweis von Tumor im Biopsie Restwert Verletzung, gab eine vollständige Antwortrate von 20% zurück.
- Unter den 38 Patienten mit einem objektiven Ansprechen haben 31 Patienten (82%) ein kontinuierliches Ansprechen im Bereich von mindestens 1,9 bis 18,6 Monaten.
- das Median Antwortdauer nicht erreicht.
- Es gab keine Hinweise auf eine bessere objektive Ansprechrate bei lokal fortgeschrittenen BCC-Patienten, die randomisiert 800 mg Sonidegib täglich erhielten und mindestens 12 Monate lang nachbeobachtet wurden.
- Chemotherapie enthalten Dacarbazin 1000 mg / m2 alle 3 Wochen oder die Kombination von Carboplatin AUC (Fläche unter der Kurve) 6 alle 3 Wochen plus Paclitaxel 175 mg / m2 alle 3 Wochen.
- das primär Der Endpunkt war die objektive Ansprechrate (ORR), definiert als der Anteil der Patienten mit bestätigter vollständiger oder teilweiser Tumorreaktion oder -reduktion, gemessen von einem zentralen Überprüfungsausschuss.
- Die Bewertung der Tumorantwort basierte auf einer zusammengesetzten Bewertung, die Tumormessungen integrierte, die durch radiologische Bewertungen des Ziels erhalten wurden. Verletzungen (nach RECIST 1.1 oder mRECIST), digitale klinische Fotografie und Histopathologie Auswertungen (per Punsch Biopsien).
- Alle verwendeten Modalitäten müssen das Fehlen eines Tumors nachgewiesen haben, um eine zusammengesetzte Bewertung der vollständigen Reaktion zu erreichen.
- Die Reaktionsdauer, die durch eine verblindete zentrale Überprüfung ermittelt wurde, war ein wichtiges sekundäres Ergebnismaß.
Nebenwirkungen: Erfahrung in klinischen Studien
- Unerwünschte Reaktion Die in klinischen Studien mit einem Arzneimittel beobachteten Raten spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider, da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden.
- Die Häufigkeit häufiger Nebenwirkungen war bei mit 800 mg Sonidegib behandelten Patienten höher als bei 200 mg.
- Die Tabellen 1 und 2 spiegeln wider Nebenwirkungen bei> 10% von Patienten, die täglich 200 mg Sonidegib ausgesetzt waren (79 Patienten mit lokal fortgeschrittenem BCC [n = 66] oder metastasiertem BCC [13]).
- Die Patienten wurden mindestens 18 Monate lang beobachtet.
- Die mediane Behandlungsdauer betrug 11,0 Monate (Bereich 1,3 bis 33,5 Monate).
Bewegungsapparat und Bindegewebe Störungen
- Muskelkrämpfe 54% (3% Grad 3)
- Myalgie (Muskelschmerzen) 19% (0)
- Muskel-Skelett-Schmerz 32 (1%)
Haut und subkutan Gewebestörungen
- Alopezie 53% (0 Klasse 3)
- Pruritus 10% (0)
Störungen des Nervensystems
- Dysgeusie (abnormaler Geschmack) 46% (0 Grad 3)
- Kopfschmerz 15% (1%)
Reaktionen an der Verabreichungsstelle
- Schmerz 14% (1% Grad 3)
Gastrointestinale Störungen
- Übelkeit 39% (1% Grad 3)
- Durchfall 32% (1%)
- Bauchschmerzen 18% (0)
- Erbrechen 11% (1%)
Stoffwechsel und Ernährung
- Verminderter Appetit 23% (1% Grad 3)
Schlüssellabor Anomalien
- Ist gestiegen Serum Kreatinkinase (Muskel Enzym) 61% (8% Grad 3-4)
- Hyperglykämie 51% (4%)
- Ist gestiegen Alanin-Aminotransferase 43% (13%)
- Ist gestiegen Aspartat-Aminotransferase 19% (4%)
- Amylase 16% (1%) erhöhte sich
- Anämie 32% (0)
- Lymphopenie (reduziert Lymphozyten) 28% (3%)
Langzeit-Follow-up: Erfahrung in klinischen Studien
- Sonidegib zeigte bei Patienten mit fortgeschrittenem Basalzellkarzinom eine anhaltende Antitumoraktivität ohne neue Sicherheitsbedenken, basierend auf den Ergebnissen einer 30-monatigen Nachuntersuchung der auf der ASCO-Jahrestagung 2016 vorgestellten zentralen BOLT-Studie.
- Das primäre Ergebnismaß war die objektive Rücklaufquote.
- Zu den sekundären Endpunkten gehörten die Dauer der Reaktion, die vollständige Reaktion, das progressionsfreie Überleben, das Gesamtüberleben und die Sicherheit.
- Bei der 30-monatigen Nachuntersuchung hatten Patienten mit lokal fortgeschrittenem BCC eine objektive Ansprechrate von 56% und 45% mit den 2 Studiendosen von 200 mg bzw. 800 mg Sonidegib.
- Bei Patienten mit metastasiertem BCC betrugen die objektiven Ansprechraten bei der niedrigsten und höchsten Dosis 8% bzw. 17%.
- In der lokal fortgeschrittenen Gruppe betrug die vollständige Ansprechrate 5%, die partielle Ansprechrate 52% und die stabile Krankheitsrate 35%.
- Die mediane Ansprechdauer betrug 26,1 Monate, das mediane progressionsfreie Überleben 22,1 Monate und die 2-Jahres-Gesamtüberlebensrate 93% (95% CI, 80-98).
- Bei Patienten mit metastasiertem BCC, die mit der 200-mg-Dosis behandelt wurden, gab es keine vollständigen Reaktionen, die partielle Ansprechrate betrug 8%, die stabile Krankheitsrate betrug 85% und die Rate von progressiv Die Krankheit war 0.
- Die mediane Ansprechdauer betrug 24 Monate, das mediane progressionsfreie Überleben 13,1 Monate (95% CI, 5,6-33,1) und die 2-Jahres-Gesamtüberlebensrate 69%. (95% CI, 31-89).
- Alle Patienten, die die 800-mg-Dosis und 97,5% der Patienten erhielten, die die 200-mg-Dosis erhielten, erlebten mindestens 1 unerwünschtes Ereignis.
- Die Raten von unerwünschten Ereignissen vom Grad 3/4 (43% gegenüber 64%) und schwerwiegenden unerwünschten Ereignissen (20% gegenüber 39%) waren mit der 200-mg-Dosis gegenüber der 800-mg-Dosis niedriger.
- Unter den 79 Patienten, die 200 mg Sonidegib erhielten, waren Muskelkrämpfe (54%), Alopezie (49%), Dysgeusie (44%), Übelkeit (39%), Durchfall (32%) die häufigsten unerwünschten Ereignisse aller Schweregrade. ) und Gewichtsabnahme (30%).
- Die häufigsten unerwünschten Ereignisse vom Grad 3/4 waren eine erhöhte Kreatininkinase (7%), ein verringertes Gewicht (5%) und Muskelkrämpfe (3%).
Zukünftige Richtungen für Sonidegib
- Sonidegib hat gezeigt Wirksamkeit bei der Behandlung von nicht resezierbar Lokal fortgeschrittenes und metastasiertes Basalzellkarzinom.
- Die identifizierten Toxizitäten sind nach Absetzen der Behandlung beherrschbar und reversibel.
- Sonidegib wurde jedoch noch nicht mit anderen zugelassenen Hedgehog-Pathway-Inhibitor-Therapien für Basalzellkarzinome wie Vismodegib verglichen.
- Basierend auf den auf der ASCO-Jahrestagung 2016 vorgestellten Ergebnissen hat eine große Studie (STEVIE-Studie; n = 1215) die Vorteile von Vismodegib bei Basalzellkarzinomen bestätigt.
- Das akzeptable Nutzen-Risiko-Profil von Sonidegib zusammen mit dem Mangel an Behandlungsmöglichkeiten macht Sonidegib zu einer neuen Option für die Behandlung von Erwachsenen mit lokal fortgeschrittenem BCC, die nach einer Operation oder Strahlentherapie wieder aufgetreten sind, oder bei solchen, die dies nicht getan haben. sind Kandidaten für eine Operation oder Bestrahlung. Therapie.
- Die fortgesetzte Zulassung von Sonidegib zur Behandlung von Basalzellkarzinomen hängt von der Überprüfung des klinischen Nutzens in Bestätigungsstudien ab.