Invoering
In juli 2015 keurde de Amerikaanse FDA (Food and Drug Administration) sonidegib (Odomzo®; Novartis, New Jersey, VS) voor de behandeling van volwassen patiënten met basaal cel carcinoom (BCC).
De Europese Commissie keurde het gebruik van sonidegib voor basaalcelcarcinoom goed in augustus 2015. In juni 2016 werd in Zwitserland een handelsvergunning verleend voor sonidegib voor de behandeling van volwassenen met gevorderd basaalcelcarcinoom. Het medicijn is ook goedgekeurd in Australië, maar is nog niet verkrijgbaar in Nieuw-Zeeland.
Sonidegib is een remmer van Hedgehog Way. Bindt aan en remt Smoothened, een transmembraan eiwit neemt deel aan Hedgehog-signaaltransductie, die een cruciale rol speelt bij het onderhoud van stamcellen en weefselherstel.
Sonidegib is geïndiceerd voor de behandeling van volwassen patiënten met lokaal gevorderd basaalcelcarcinoom (BCC) dat is teruggekeerd na een operatie of radiotherapie, of degenen die geen kandidaat zijn voor een operatie of radiotherapie.
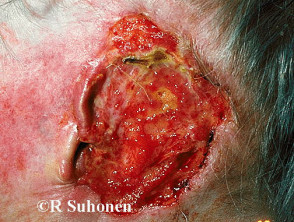
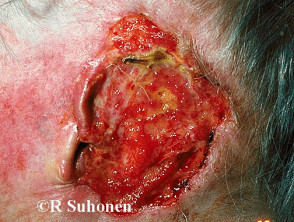
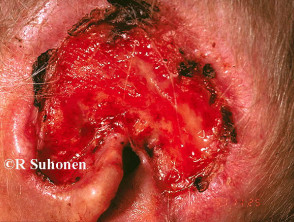
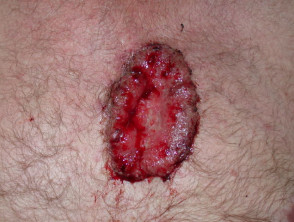
Gevorderd basaalcelcarcinoom
Gevorderd basaalcelcarcinoom
Gevorderd basaalcelcarcinoom
Gevorderd basaalcelcarcinoom
Ervaring in klinische studies met sonidegib
- De FDA-goedkeuring was gebaseerd op een cruciale fase II-studie (BOLT-studie), een dubbelblind, gerandomiseerd, niet-vergelijkende tweearmige studie bij patiënten met lokaal gevorderde BCC die niet vatbaar zijn voor lokale therapie of metastatisch basaalcelcarcinoom.
- Patiënten werden gerandomiseerd (2:1) om sonidigib 800 mg (n=151) of 200 mg (n=79) oraal te krijgen, eenmaal daags, totdat ziekteprogressie of ondraaglijk werd. toxiciteit.
- Randomisatie was gestratificeerd naar stadium van de ziekte (lokaal gevorderd of gemetastaseerd), lokaal gevorderde BCC-ziekte histologie (agressief versus niet-agressief) en geografische regio.
- Patiënten met lokaal gevorderd BCC die werden behandeld met sonidegib 200 mg (n=66) werden gedurende ten minste 12 maanden gevolgd, tenzij de behandeling eerder werd gestaakt.
- Het objectieve responspercentage was 58% (95% betrouwbaarheidsinterval: 45-70), bestaande uit 5% (n=3) volledige responsen en 53% (n=35) gedeeltelijke responsen.
- Een vooraf gespecificeerde gevoeligheidsanalyse waarbij gebruik wordt gemaakt van een alternatieve definitie van volledige respons, gedefinieerd als ten minste een gedeeltelijke respons volgens Magnetische resonantie en/of foto en zonder bewijs van tumor in biopsie overblijvend blessure, retourneerde een volledig responspercentage van de 20%.
- Van de 38 patiënten met een objectieve respons hadden 31 patiënten (82%) een continue respons variërend van ten minste 1,9 tot 18,6 maanden.
- de mediaan- reactieduur niet bereikt.
- Er was geen bewijs van een verbeterd objectief responspercentage bij patiënten met lokaal gevorderd BCC, gerandomiseerd naar sonidegib 800 mg per dag en gevolgd gedurende ten minste 12 maanden.
- Chemotherapie inclusief dacarbazine 1000 mg/m22 elke 3 weken of carboplatine combinatie AUC (area under the curve) 6 elke 3 weken plus paclitaxel 175 mg/m22 elke 3 weken.
- de primair Het eindpunt was het objectieve responspercentage (ORR), gedefinieerd als het percentage patiënten met bevestigde volledige of gedeeltelijke tumorrespons of -reductie, zoals gemeten door een centrale beoordelingscommissie.
- De beoordeling van de tumorrespons was gebaseerd op een samengestelde beoordeling die tumormetingen integreerde die werden verkregen door middel van gerichte radiografische beoordelingen. verwondingen (volgens RECIST 1.1 of mRECIST), digitale klinische fotografie en histopathologie evaluaties (via punch biopsieën).
- Alle gebruikte modaliteiten moeten de afwezigheid van een tumor hebben aangetoond om een samengestelde beoordeling van volledige respons te verkrijgen.
- De duur van de respons, bepaald door een geblindeerde centrale beoordeling, was een belangrijke secundaire uitkomstmaat.
Bijwerkingen: ervaring in klinische studies
- Tegengestelde reactie De percentages die worden waargenomen in klinische onderzoeken met een geneesmiddel, weerspiegelen mogelijk niet de percentages die worden waargenomen in de klinische praktijk, omdat klinische onderzoeken worden uitgevoerd onder zeer uiteenlopende omstandigheden.
- De frequentie van vaak voorkomende bijwerkingen was hoger bij patiënten die werden behandeld met sonidegib 800 mg in vergelijking met 200 mg.
- Tabellen 1 en 2 weerspiegelen bijwerkingen bij >10% van patiënten die werden blootgesteld aan sonidegib 200 mg per dag (79 patiënten met lokaal gevorderd BCC [n=66] of gemetastaseerd BCC [13]).
- De patiënten werden gedurende ten minste 18 maanden gevolgd.
- De mediane duur van de behandeling was 11,0 maanden (variërend van 1,3 tot 33,5 maanden).
bewegingsapparaat Y bindweefsel stoornissen
- Spierspasmen 54% (3% Graad 3)
- Spierpijn (spierpijn) 19% (0)
- Musculoskeletale pijn 32 (1%)
huid en onderhuids weefsel aandoeningen
- alopecia 53% (0 graden 3)
- pruritus 10% (0)
Zenuwstelselaandoeningen
- dysgeusie (abnormale smaak) 46% (0 Graad 3)
- Hoofdpijn 15% (1%)
Reacties op de toedieningsplaats
- Pijn 14% (1% Graad 3)
Maagdarmstelselaandoeningen
- Misselijkheid 39% (1% Graad 3)
- Diarree 32% (1%)
- Buikpijn 18% (0)
- Braken 11% (1%)
Metabolisme en voeding
- Verminderde eetlust 23% (1% Graad 3)
sleutel laboratorium afwijkingen
- Is gestegen serum creatinekinase (spier enzym) 61% (8% Graad 3-4)
- hyperglycemie 51% (4%)
- Is gestegen alanine aminotransferase 43% (13%)
- Is gestegen aspartaataminotransferase 19% (4%)
- Verhoogd amylase 16% (1%)
- Bloedarmoede 32% (0)
- lymfopenie (verminderd lymfocyten) 28% (3%)
Follow-up op lange termijn: ervaring in klinische onderzoeken
- Sonidegib vertoonde aanhoudende antitumoractiviteit zonder nieuwe veiligheidsproblemen bij patiënten met gevorderd basaalcelcarcinoom, op basis van 30 maanden follow-upresultaten van de centrale BOLT-studie die werd gepresenteerd op de ASCO-jaarvergadering van 2016.
- De primaire uitkomstmaat was het objectieve responspercentage.
- Secundaire eindpunten waren responsduur, volledige respons, progressievrije overleving, totale overleving en veiligheid.
- Bij de follow-up na 30 maanden hadden patiënten met lokaal gevorderd BCC een objectief responspercentage van 56% en 45% met de 2 onderzoeksdoses van respectievelijk 200 mg en 800 mg sonidegib.
- Onder patiënten met gemetastaseerd BCC waren de objectieve responspercentages bij de laagste en hoogste doses respectievelijk 8% en 17%.
- In de lokaal gevorderde groep was het volledige responspercentage 5%, het partiële responspercentage 52% en het stabiele ziektepercentage 35%.
- De mediane responsduur was 26,1 maanden, de mediane PFS was 22,1 maanden en het totale overlevingspercentage na 2 jaar was 93% (95% BI, 80-98).
- Bij patiënten met gemetastaseerd BCC die werden behandeld met de dosis van 200 mg, waren er geen volledige responsen, het partiële responspercentage was 8%, het stabiele ziektepercentage 85% en het percentage progressief ziekte was 0.
- De mediane duur van de respons was 24 maanden, de mediane PFS was 13,1 maanden (95% BI, 5,6-33,1) en het totale overlevingspercentage na 2 jaar was 69% (95% BI, 31-89).
- Alle patiënten die de dosis van 800 mg kregen en 97.5% van de patiënten die de dosis van 200 mg kregen, ondervonden ten minste 1 nadelige gebeurtenis.
- De percentages graad 3/4 bijwerkingen (43% versus 64%) en ernstige bijwerkingen (20% versus 39%) waren lager bij de dosis van 200 mg versus de dosis van 800 mg.
- Van de 79 patiënten die sonidegib 200 mg kregen, waren de meest voorkomende bijwerkingen van alle graden spierspasmen (54%), alopecia (49%), dysgeusie (44%), misselijkheid (39%), diarree (32%). ) en gewichtsverlies (30%).
- De meest voorkomende bijwerkingen van graad 3/4 waren verhoogd creatininekinase (7%), gewichtsverlies (5%), spierspasmen (3%).
Toekomstige aanwijzingen voor sonidegib
- Sonidegib heeft laten zien effectiviteit bij de behandeling van inoperabel lokaal gevorderd en gemetastaseerd basaalcelcarcinoom.
- Geïdentificeerde toxiciteiten zijn beheersbaar en reversibel na stopzetting van de behandeling.
- Sonidegib is echter nog niet vergeleken met andere goedgekeurde hedgehog-pathway-remmertherapieën voor basaalcelcarcinoom, zoals vismodegib.
- Op basis van de resultaten gepresenteerd op de ASCO-jaarvergadering van 2016, heeft een groot onderzoek (STEVIE-onderzoek; n=1.215) de voordelen van vismodegib voor basaalcelcarcinoom bevestigd.
- Het aanvaardbare baten-risicoprofiel van sonidegib, samen met het gebrek aan behandelingsopties, maakt sonidegib tot een opkomende optie voor de behandeling van volwassenen met lokaal gevorderd BCC dat is teruggekomen na een operatie of bestralingstherapie, of bij degenen bij wie dat niet het geval is. operatie of bestraling. behandeling.
- Voortdurende goedkeuring van sonidegib voor de behandeling van basaalcelcarcinoom zal afhangen van verificatie van het klinisch voordeel in bevestigende onderzoeken.