Was ist Nivolumab?
Nivolumab (OPDIVO®, Bristol Myers Squibb, NJ, USA) ist ein programmierter menschlicher Tod Empfänger-1 (PD-1) -Sperre Antikörper, zugelassen für fortgeschrittene Behandlung Melanom.
Wofür wird Nivolumab angewendet?
Im Dezember 2014 genehmigte die US-amerikanische Food and Drug Administration (FDA) die Verwendung von Nivolumab in:
- Patienten mit nicht resezierbar oder metastatisch Melanom und Krankheitsverlauf nach Behandlung mit Ipilimumab (Yervoy®)
- BRAF V600 Mutation Melanom-positive Patienten mit Krankheitsverlauf trotz Behandlung mit Ipilimumab und a BRAF Inhibitor (zum Beispiel Vemurafenib oder Dabrafenib).
Im Oktober 2015 wurde die Anwendung von Nivolumab in Kombination mit Ipilimumab zugelassen, um das Ansprechen bei fortgeschrittenem Melanom (nicht resezierbare oder metastatische Erkrankung) zu verbessern. Im Januar 2016 wurde es auch bei unbehandeltem BRAF-Wildtyp-Melanom zugelassen. Im Dezember 2017 genehmigte die FDA Nivolumab für Assistent Behandlung von Patienten mit Melanom und Beteiligung von Lymphe Knoten oder metastasierende Krankheit, die a Resektion.
In der Europäischen Union hat die Europäische Arzneimittel-Agentur (EMA) den Antrag auf Genehmigung für das Inverkehrbringen von Nivolumab bei fortgeschrittenem Melanom zur Überprüfung validiert. Der Antrag wurde auch vom CHMP (Ausschuss für Humanarzneimittel) der EMA beschleunigt bewertet. Nivolumab ist in Neuseeland erhältlich und wird von PHARMAC für einige Fälle von nicht resezierbarem fortgeschrittenem metastasiertem Melanom finanziert.
Im Juni 2014 genehmigte die Europäische Kommission Nivolumab gegen PD-1 immun Checkpoint-Inhibitorzur Behandlung von fortgeschrittenem Melanom (nicht resezierbar oder metastasierend) bei Erwachsenen, unabhängig vom BRAF-Status. Mit der Zulassung kann Nivolumab in allen 28 EU-Mitgliedstaaten vermarktet werden. Es folgt eine beschleunigte Bewertung durch den Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur, die am 24. April 2015 angekündigt wurde. Die Genehmigung basierte auf der CheckMate-066-Studie, die dies demonstrierte höher Gesamtüberleben im Vergleich zu Dacarbazin in der Erstlinieneinstellung und in der CheckMate-037-Studie, die eine bessere Reaktion im Vergleich zu Dacarbazin zeigt Chemotherapie bei zuvor behandelten Patienten.
Im Juli 2018 genehmigte die Europäische Kommission (EC) Nivolumab zur Zusatzbehandlung von erwachsenen Melanompatienten mit Lymphknotenbefall oder metastasierender Erkrankung, die sich einer vollständigen Resektion unterzogen haben. Diese Anzeige gilt für BRAF Mutant und Wildtyp-Melanom-Patienten. Mit dieser Entscheidung erhält Nivolumab als erste und einzige PD-1-Therapie die CE-Zulassung im adjuvanten Umfeld. Die Genehmigung basierte auf den Ergebnissen der laufenden randomisierten Phase 3, Doppelblind CheckMate-238 Test.
Nivolumab ist in Neuseeland erhältlich und wird von PHARMAC für einige Fälle von nicht resezierbarem fortgeschrittenem metastasiertem Melanom finanziert.
Wie wirkt Nivolumab?
- Der PD-1-Weg dient als zu begrenzender Kontrollpunkt T-Zelle–Vermittelte Immunantworten.
- Krebs Zellen können "regulatorische" Wege wie Checkpoint-Wege nutzen, um sich vor dem Immunsystem zu verstecken und das zu schützen Tumor Immunangriff.
- Beide PD-1-Liganden, PD-L1 (programmierter Todesrezeptorligand 1) und PD-L2, aktivieren den PD-1-Rezeptor und induzieren die PD-1-Signalübertragung und die damit verbundene "Depletion" von T-Zellen, a Hemmung Aktivierung von T-Zellen und Proliferation.
- Die PD-L1 / PD-1-Wechselwirkung hemmt die Immunaktivierung und reduziert T-Zellen zytotoxisch Aktivität bei Bedarf.
- Diese negative Rückkopplungsschleife ist wichtig, um normale Immunantworten aufrechtzuerhalten und die T-Zell-Aktivität zu begrenzen, um normale Zellen währenddessen zu schützen chronisch Entzündung.
- Tumorzellen können die T-Zell-vermittelte Zytotoxizität umgehen, indem sie PD-L1 im Tumor selbst oder bei der Tumorinfiltration exprimieren Immunzellen, was zur Hemmung der immunvermittelten Zerstörung von Tumorzellen führt.
- Die abnormale Expression von PD-L1 auf der Oberfläche von Melanomzellen aktiviert PD-1 und unterdrückt die Aktivität von zytotoxischen T-Zellen.
- Diese Toleranz gegenüber T-Zellen ermöglicht es Tumorzellen, die Erkennung und den Angriff des Immunsystems zu vermeiden.
- Nivolumab ist ein hochselektives Humanisat. monoklonal IgG4-Antikörper, der bei Aktivierung an den PD-1-Checkpoint-Rezeptor bindet T-Zellen. und blockiert seine Wechselwirkung mit PD-L1 und PD-L2, wodurch die Hemmung der Immunantwort gegen Tumorzellen, die durch den PD-1-Weg vermittelt werden, aufgehoben wird.
Wie wird Nivolumab verabreicht?
- Nivolumab wird alle 2 Wochen in einer Dosis von 3 mg / kg intravenös verabreicht und über 1 Stunde infundiert.
- Die Behandlung wird fortgesetzt, bis die Krankheit fortschreitet oder nicht mehr akzeptabel ist. Toxizität.
- Bei Nivolumab in Kombination mit Ipilumab sollte Nivolumab zuerst verabreicht werden, gefolgt von der Infusion von Ipilimumab.
- Die empfohlene Dosis von Nivolumab in der Kombinationsphase beträgt 1 mg / kg intravenös über 60 Minuten alle 3 Wochen für die ersten 4 Dosen in Kombination mit Ipilumab 3 mg / kg intravenös über 90 Minuten. Darauf sollte eine Nivolumab-Monotherapie folgen.
- Nivolumab und Ipilumab sollten unter Aufsicht von Ärzten verabreicht und überwacht werden, die Erfahrung mit der Anwendung der Immuntherapie haben.
- Wenn OPDIVO in Kombination mit YERVOY (Ipilimumab) verabreicht wird und ein Wirkstoff abgesetzt wird, sollte auch der andere abgesetzt werden.
Dosisänderungen
- Hypothyreose oder Hyperthyreose: Keine empfohlenen Dosisänderungen.
- Nieren Verschlechterung: Keine Dosisanpassungen erforderlich.
- Leicht hepatisch Verschlechterung: Keine Dosisanpassungen erforderlich.
- Mäßige oder schwere Leberfunktionsstörung: Es liegen keine Studien vor.
Unterbrechen Sie die Medikation bei einer der folgenden Erkrankungen
- Note 2 Pneumonitis
- Note 2 oder 3 Kolitis
- AST oder ALT > 3-5 x obere Normalgrenze (UNL) oder insgesamt Bilirubin > 1,5-3 x UNL
- Serum Kreatinin> 1,5-6 x UNL oder> 1,5 mal Base
- Jede andere verwandte Grad 3 oder ernsthafte Behandlung Nebenwirkungen
- Die Behandlung kann bei Patienten fortgesetzt werden, deren Nebenwirkungen sich auf Grad 0-1 erholen.
Unter einer der folgenden Bedingungen dauerhaft aussetzen
- Jede lebensbedrohliche oder unerwünschte Reaktion 4. Grades
- Pneumonitis 3. oder 4. Grades
- Colitis Grad 4
- AST oder ALT> 5 x UNL oder Gesamtbilirubin> 3 x UNL
- Serumkreatinin> 6 x UNL
- Jede ernsthafte oder Grad 3 Behandlung Nebenwirkung das wird wiederholt
- Unfähigkeit zu reduzieren Kortikosteroid Dosis bei ≤ 10 mg / Tag Prednison oder Äquivalent in 12 Wochen
- Hartnäckig Behandlungsbedingte Nebenwirkungen 2. oder 3. Grades, die sich innerhalb von 12 Wochen nach der letzten Dosis nicht auf Grad 0-1 erholen.
Link zu wichtigen Erkenntnissen aus klinischen Studien mit Nivolumab
Mögliche Wechselwirkungen mit Nivolumab
- Nicht formell Pharmakokinetik Arzneimittelwechselwirkungsstudien wurden mit Nivolumab durchgeführt.
- Nivolumab ist ein menschlicher monoklonaler Antikörper und wird als solcher nicht durch Cytochrom P450 (CYP) metabolisiert. Enzyme oder andere Arzneimittel metabolisierende Enzyme. Hemmung oder Induktion Es wird nicht erwartet, dass diese Enzyme durch gleichzeitige Verabreichung von Arzneimitteln die Pharmakokinetik von Nivolumab.
Was sind die Nebenwirkungen von Nivolumab?
In klinischen Studien die folgenden Nebenwirkungen wurden in a beobachtet Vorfall > 10%: erhöht Alanin-Aminotransferase (28%), Hyponatriämie (25%), erhöhte Alkalität Phosphatase (22%), Eruption (21%), Juckreiz (19%), Husten (17%), ALT erhöht (16%), Hyperkaliämie (15%), obere Atemwege Infektion (11%).
Andere klinisch wichtige unerwünschte Ereignisse, die mit einer Inzidenz von 1 bis 10% auftreten, sind:
- Herzerkrankungen: ventrikulär Arrhythmie
- Augenerkrankungen: Iridozyklitis.
- Infusionsbedingte Reaktionen
- Immunvermittelte Störungen: schwere Pneumonitis oder interstitial Lungenerkrankung, Kolitis, Hepatitis, Nephritis und Schilddrüsenerkrankungen
- In klinischen Studien traten immunbedingte Nebenwirkungen häufiger auf, wenn Nivolumab in Kombination mit Ipilimumab verabreicht wurde als Nivolumab allein.
- Die meisten immunbedingten Nebenwirkungen besserten sich oder lösten sich mit einer geeigneten Behandlung auf, einschließlich der Einleitung von Kortikosteroide und Dosisänderungen.
In einer klinischen Studie zur Kombination von Nivolumab und Ipilimumab wurde 36% aufgrund von Nebenwirkungen, hauptsächlich Durchfall und erhöhten Leberfunktionstests, abgebrochen.
Haut Nebenwirkungen von Nivolumab
Hautkomplikationen treten häufig bei Patienten auf, die mit Nivolumab behandelt werden, und etwa 40% der Patienten erleben sie mit halb Der Beginn der Eruption tritt ungefähr 10 Monate nach Beginn der Behandlung auf. Gemeldete Reaktionen umfassen:
- Morbilliform Eruption
- Pruritus
- Flechte Eruption
- Schuppenflechte
- Ekzem
- Vitiligo und Poliose (Aufhellung von Haar)
- Stomatitis
- Bullös Pemphigoid
- Sarkoid Granulom
- Multiple Keratoakanthome.
Bei einigen Patienten, die PD-1 einnahmen, wurde über eine Verdunkelung der Haare berichtet Inhibitoren für nichtkleinzelligen Lungenkrebs [1].
Siehe auch Hautnebenwirkungen von Checkpoint-Inhibitoren.
Meldung vermuteter Nebenwirkungen
Zur kontinuierlichen Überwachung des Nutzen-Risiko-Verhältnisses von Nivolumab werden Angehörige der Gesundheitsberufe gebeten, vermutete Nebenwirkungen dem neuseeländischen Zentrum für Pharmakovigilanz zu melden.
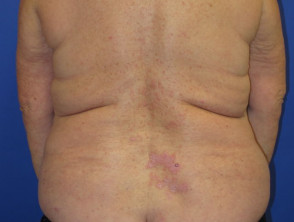
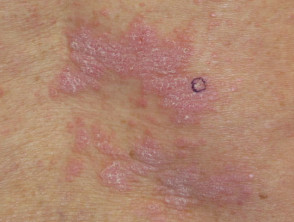
Nivolumab-induzierte Lichenoid-Dermatitis
Nivolumab-induzierte Lichenoid-Dermatitis
Nivolumab-induzierte Lichenoid-Dermatitis
Anwendung von Nivolumab während der Schwangerschaft
- Vorfälle von Missbildungen Ein Schwangerschaftsverlust bei Schwangerschaften beim Menschen wurde für Nivolumab nicht festgestellt.
- Nivolumab sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
- In Tierreproduktionsstudien wurde die Verabreichung an Cynomolgus-Affen seit dem anfang von Organogenese während der Entbindung kam es zu einer Zunahme von Fehlgeburten und vorzeitigem Tod des Fötus.
- Es ist bekannt, dass menschliches IgG4 die Plazentaschranke passiert, und Nivolumab ist ein IgG4. Daher hat Nivolumab das Potenzial, von der Mutter auf übertragen zu werden Entwicklung Fötus.
- Die Wirkungen von Nivolumab sind im zweiten und dritten Schwangerschaftstrimester wahrscheinlich am größten. Es sind keine menschlichen Daten verfügbar, um über das mit dem Medikament verbundene Risiko zu informieren.
Anwendung von Nivolumab bei stillenden Müttern
- Es ist nicht bekannt, ob Nivolumab oder seine Metaboliten sind in der Muttermilch vorhanden.
- Empfehlen Sie Frauen, das Stillen während der Behandlung abzubrechen.
Pädiatrisch Verwendung von Nivolumab
Die Sicherheit und Wirksamkeit von Nivolumab bei pädiatrischen Patienten wurde nicht nachgewiesen. Nivolumab darf nicht bei Kindern unter 18 Jahren angewendet werden.
Geriatrische Anwendung von Nivolumab
Die klinischen Studien mit Nivolumab umfassten nicht genügend Patienten ab 65 Jahren, um festzustellen, ob sie auf jüngere Patienten unterschiedlich ansprechen. Es gibt keine allgemeinen Sicherheitsunterschiede oder Wirksamkeit wurden bei älteren Patienten (≥ 65 Jahre) und jüngeren Patienten (<65 años). No se requiere ajuste de dosis para pacientes de edad avanzada (≥ 65 años).
Nierenversagen und Nivolumab
Basierend auf einer populationspharmakokinetischen Analyse wird bei Patienten mit Nierenfunktionsstörung keine Dosisanpassung empfohlen.
Leberversagen und Nivolumab
Basierend auf einer populationspharmakokinetischen Analyse wird für Patienten mit leichter Leberfunktionsstörung keine Dosisanpassung empfohlen. Nivolumab wurde bei Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung nicht untersucht.