¿Qué es nivolumab?
Nivolumab (OPDIVO®, Bristol Myers Squibb, Nueva Jersey, EE. UU.) Es una muerte humana programada receptor-1 (PD-1) -bloqueo anticuerpo, aprobado para el tratamiento de avanzada melanoma.
¿Para qué se utiliza nivolumab?
En diciembre de 2014, la Administración de Drogas y Alimentos de los EE. UU. (FDA) aprobó el uso de nivolumab en:
- Pacientes con irresecable o metastásico melanoma y progresión de la enfermedad después del tratamiento con ipilimumab (Yervoy®)
- BRAF V600 mutación pacientes con melanoma positivo con progresión de la enfermedad a pesar del tratamiento con ipilimumab y un BRAF inhibidor (por ejemplo, vemurafenib o dabrafenib).
En octubre de 2015, se aprobó el uso de nivolumab en combinación con ipilimumab para mejorar la respuesta en el melanoma avanzado (enfermedad irresecable o metastásica). En enero de 2016, también se aprobó en el melanoma de tipo salvaje BRAF no tratado. En diciembre de 2017, la FDA aprobó nivolumab para auxiliar tratamiento de pacientes con melanoma y afectación de linfa nodos o enfermedad metastásica que se ha sometido a una resección.
En la Unión Europea, la Agencia Europea de Medicamentos (EMA) ha validado para su revisión la solicitud de autorización de comercialización de nivolumab en melanoma avanzado. La solicitud también ha recibido una evaluación acelerada por parte del CHMP (Comité de Medicamentos de Uso Humano) de la EMA. Nivolumab está disponible en Nueva Zelanda y está financiado por PHARMAC para algunos casos de melanoma avanzado metastásico e irresecable.
En junio de 2014, la Comisión Europea aprobó nivolumab a PD-1 inmune inhibidor de punto de control, para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos, independientemente del estado BRAF. La aprobación permite la comercialización de nivolumab en los 28 Estados miembros de la UE. Sigue una evaluación acelerada del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos, que se anunció el 24 de abril de 2015. La aprobación se basó en el ensayo CheckMate-066 que demostró superior supervivencia general frente a dacarbazina en el entorno de primera línea y el ensayo CheckMate-037 que muestra una mejor respuesta frente a quimioterapia en pacientes tratados previamente.
En julio de 2018, la Comisión Europea (CE) aprobó nivolumab para el tratamiento adyuvante de pacientes adultos con melanoma con afectación de ganglios linfáticos o enfermedad metastásica que se han sometido a una resección completa. Esta indicación es para BRAF mutante y pacientes con melanoma de tipo salvaje. Con esta decisión, nivolumab se convierte en la primera y única terapia con PD-1 en recibir una aprobación de CE en el entorno adyuvante. La aprobación se basó en los resultados de la fase 3 en curso aleatorizada, doble ciego Prueba CheckMate-238.
Nivolumab está disponible en Nueva Zelanda y está financiado por PHARMAC para algunos casos de melanoma avanzado metastásico e irresecable.
¿Cómo actúa nivolumab?
- La vía PD-1 sirve como punto de control para limitar Célula T–Respuestas inmunitarias mediadas.
- Cáncer Las células pueden aprovechar las vías "reguladoras", como las vías de los puestos de control, para esconderse del sistema inmunológico y proteger al tumor del ataque inmunológico.
- Ambos ligandos PD-1, PD-L1 (ligando 1 del receptor de muerte programada) y PD-L2, activan el receptor PD-1 e inducen la señalización PD-1 y el "agotamiento" asociado de las células T, un inhibición de activación de células T y proliferación.
- La interacción PD-L1 / PD-1 inhibe la activación inmunitaria y reduce las células T citotóxico actividad cuando está obligado.
- Este circuito de retroalimentación negativa es esencial para mantener las respuestas inmunitarias normales y limita la actividad de las células T para proteger las células normales durante crónico inflamación.
- Las células tumorales pueden eludir la citotoxicidad mediada por células T al expresar PD-L1 en el propio tumor o en infiltración tumoral células inmunes, lo que resulta en la inhibición de la destrucción de células tumorales mediada por el sistema inmunitario.
- La expresión anormal de PD-L1 en la superficie de las células de melanoma activa PD-1 y suprime la actividad de las células T citotóxicas.
- Esta tolerancia de las células T permite que las células tumorales eviten el reconocimiento y el ataque del sistema inmunológico.
- Nivolumab es un humanizado altamente selectivo. monoclonal Anticuerpo IgG4 que se une al receptor de punto de control PD-1 al activarse Células T. y bloquea su interacción con PD-L1 y PD-L2, liberando la inhibición de la respuesta inmune contra las células tumorales mediada por la vía PD-1.
¿Cómo se administra nivolumab?
- Nivolumab se administra por vía intravenosa a una dosis de 3 mg / kg cada 2 semanas y se infunde durante 1 hora.
- El tratamiento se continúa hasta que la enfermedad progresa o es inaceptable. toxicidad.
- Para nivolumab en combinación con ipilumab, primero se debe administrar nivolumab seguido de la infusión de ipilimumab.
- La dosis recomendada de nivolumab en la fase de combinación es de 1 mg / kg administrado por vía intravenosa durante 60 minutos cada 3 semanas durante las primeras 4 dosis en combinación con ipilumab 3 mg / kg administrado por vía intravenosa durante 90 minutos. Esto debe ir seguido de nivolumab en monoterapia.
- Nivolumab e ipilumab deben administrarse y controlarse bajo la supervisión de médicos con experiencia en el uso de inmunoterapia.
- Cuando OPDIVO se administra en combinación con YERVOY (ipilimumab), si se suspende cualquiera de los agentes, también se debe suspender el otro.
Modificaciones de dosis
- Hipotiroidismo o hipertiroidismo: sin modificaciones de dosis recomendadas.
- Renal deterioro: no se requieren modificaciones de la dosis.
- Leve hepático deterioro: no se requieren modificaciones de dosis.
- Insuficiencia hepática moderada o grave: no hay estudios disponibles.
Suspenda la medicación por cualquiera de las siguientes condiciones
- Grado 2 neumonitis
- Grado 2 o 3 colitis
- AST o ALT > 3-5 x límite superior normal (UNL) o total bilirrubina > 1,5-3 x UNL
- Suero creatinina> 1,5-6 x UNL o> 1,5 veces base
- Cualquier otro tratamiento grave o de grado 3 relacionado Reacciones adversas
- El tratamiento puede reanudarse en pacientes cuyas reacciones adversas se recuperen al grado 0-1.
Suspenda permanentemente en cualquiera de las siguientes condiciones
- Cualquier reacción adversa potencialmente mortal o de grado 4
- Neumonitis de grado 3 o 4
- Colitis de grado 4
- AST o ALT> 5 x UNL o bilirrubina total> 3 x UNL
- Creatinina sérica> 6 x UNL
- Cualquier tratamiento grave o de grado 3 reacción adversa que se repite
- Incapacidad para reducir corticosteroide dosis a ≤ 10 mg / día de prednisona o equivalente en 12 semanas
- Persistente reacciones adversas de grado 2 o 3 relacionadas con el tratamiento que no se recuperan al grado 0-1 dentro de las 12 semanas posteriores a la última dosis.
Enlace a evidencia clave de ensayos clínicos sobre nivolumab
Posibles interacciones farmacológicas con nivolumab
- No formal farmacocinética Se han realizado estudios de interacciones medicamentosas con nivolumab.
- Nivolumab es un anticuerpo monoclonal humano y, como tal, no es metabolizado por el citocromo P450 (CYP). enzimas u otras enzimas metabolizadoras de fármacos. Inhibición o inducción de estas enzimas mediante la coadministración de medicamentos no se prevé que afecten al farmacocinética de nivolumab.
¿Cuáles son los efectos adversos del nivolumab?
En ensayos clínicos los siguientes eventos adversos han sido observados en un incidencia > 10%: aumentado alanina aminotransferasa (28%), hiponatremia (25%), aumento de alcalinidad fosfatasa (22%), erupción (21%), prurito (19%), tos (17%), aumento de ALT (16%), hiperpotasemia (15%), tracto respiratorio superior infección (11%).
Otros eventos adversos clínicamente importantes que ocurren con una incidencia del 1 al 10% incluyen:
- Trastornos cardíacos: ventricular arritmia
- Trastornos oculares: iridociclitis.
- Reacciones relacionadas con la infusión
- Trastornos inmunomediados: neumonitis grave o intersticial enfermedad pulmonar, colitis, hepatitis, nefritis y trastornos de la tiroides
- En ensayos clínicos, se han producido reacciones adversas relacionadas con el sistema inmunitario con mayor frecuencia cuando se administró nivolumab en combinación con ipilimumab en comparación con nivolumab en monoterapia.
- La mayoría de las reacciones adversas relacionadas con el sistema inmunitario mejoraron o se resolvieron con el tratamiento adecuado, incluido el inicio de corticosteroides y modificaciones de dosis.
Un ensayo clínico de la combinación de nivolumab e ipilimumab tuvo un abandono del 36% debido a efectos secundarios, principalmente diarrea y pruebas de función hepática elevadas.
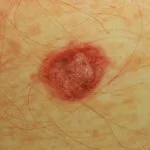
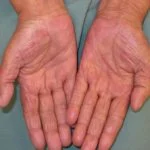
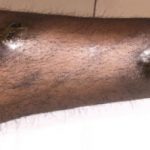
Cutáneo efectos adversos de nivolumab
Las complicaciones cutáneas son frecuentes en pacientes tratados con nivolumab, y alrededor del 40% de los pacientes las experimentan, con media el inicio de la erupción se produce aproximadamente a los 10 meses de iniciado el tratamiento. Las reacciones reportadas incluyen:
- Morbiliforme erupción
- Prurito
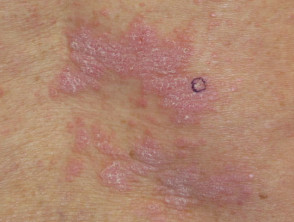
- Liquenoide erupción
- Soriasis
- Eczema
- Vitiligo y poliosis (blanqueamiento de cabello)
- Estomatitis
- Bulloso penfigoide
- Sarcoide granuloma
- Queratoacantomas múltiples.
Se ha informado oscurecimiento del cabello en algunos pacientes que toman PD-1 inhibidores para el cáncer de pulmón de células no pequeñas [1].
Ver también Efectos adversos cutáneos de inhibidores de puntos de control.
Notificación de sospechas de reacciones adversas
Para un seguimiento continuo del balance beneficio y riesgo de nivolumab, se invita a los profesionales sanitarios a notificar cualquier sospecha de reacciones adversas al Centro de Farmacovigilancia de Nueva Zelanda.
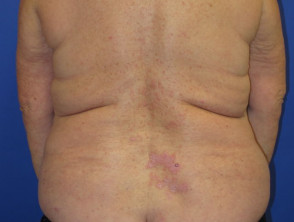
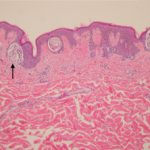
Dermatitis liquenoide inducida por nivolumab
Dermatitis liquenoide inducida por nivolumab
Dermatitis liquenoide inducida por nivolumab
Uso de nivolumab durante el embarazo
- Las incidencias de malformaciones y no se ha establecido la pérdida del embarazo en embarazos humanos para nivolumab.
- Nivolumab debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
- En estudios de reproducción animal, la administración a monos cynomolgus desde el inicio de organogénesis durante el parto resultó en un aumento de abortos y muerte fetal prematura.
- Se sabe que la IgG4 humana atraviesa la barrera placentaria y el nivolumab es una IgG4; por lo tanto, nivolumab tiene el potencial de transmitirse de la madre al desarrollando feto.
- Es probable que los efectos de nivolumab sean mayores durante el segundo y tercer trimestre del embarazo; no hay datos disponibles en humanos que informen sobre el riesgo asociado al fármaco.
Uso de nivolumab en madres lactantes
- No se sabe si nivolumab o su metabolitos están presentes en la leche materna.
- Aconseje a las mujeres que dejen de amamantar durante el tratamiento.
Pediátrico uso de nivolumab
No se ha establecido la seguridad y eficacia de nivolumab en pacientes pediátricos. Nivolumab no debe usarse en niños menores de 18 años.
Uso geriátrico de nivolumab
Los estudios clínicos de nivolumab no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes. No hay diferencias generales en seguridad o eficacia se notificaron entre pacientes de edad avanzada (≥ 65 años) y pacientes más jóvenes (<65 años). No se requiere ajuste de dosis para pacientes de edad avanzada (≥ 65 años).
Insuficiencia renal y nivolumab
Según un análisis farmacocinético poblacional, no se recomienda un ajuste de dosis en pacientes con insuficiencia renal.
Insuficiencia hepática y nivolumab
Basado en un análisis farmacocinético poblacional, no se recomienda un ajuste de dosis para pacientes con insuficiencia hepática leve. Nivolumab no se ha estudiado en pacientes con insuficiencia hepática moderada o grave.