Cos'è nivolumab?
Nivolumab (OPDIVO®, Bristol Myers Squibb, NJ, USA) È una morte umana programmata ricevitore-1 (PD-1) -blocco anticorpo, approvato per il trattamento avanzato melanoma.
A cosa serve nivolumab?
Nel dicembre 2014, la Food and Drug Administration (FDA) statunitense ha approvato l'uso di nivolumab in:
- Pazienti con non resecabile o metastatico melanoma e progressione della malattia dopo il trattamento con ipilimumab (Yervoy®)
- BRAF V600 mutazione pazienti positivi al melanoma con progressione della malattia nonostante il trattamento con ipilimumab e a BRAF inibitore (ad esempio, vemurafenib o dabrafenib).
Nell'ottobre 2015, l'uso di nivolumab in combinazione con ipilimumab è stato approvato per migliorare la risposta nel melanoma avanzato (malattia non resecabile o metastatica). Nel gennaio 2016, è stato approvato anche nel melanoma BRAF wild-type non trattato. Nel dicembre 2017, la FDA ha approvato nivolumab per assistente trattamento di pazienti con melanoma e coinvolgimento di linfa nodi o malattia metastatica che ha subito a resezione.
Nell'Unione europea, l'Agenzia europea per i medicinali (EMA) ha convalidato la domanda di autorizzazione all'immissione in commercio per nivolumab nel melanoma avanzato per la revisione. La domanda ha anche ricevuto una rapida valutazione da parte del CHMP (Comitato per i medicinali per uso umano) dell'EMA. Nivolumab è disponibile in Nuova Zelanda ed è finanziato da PHARMAC per alcuni casi di melanoma metastatico avanzato non resecabile.
Nel giugno 2014, la Commissione europea ha approvato nivolumab a PD-1 immune inibitore del checkpoint, per il trattamento del melanoma avanzato (non resecabile o metastatico) negli adulti, indipendentemente dallo stato di BRAF. L'approvazione consente a nivolumab di essere commercializzato in tutti i 28 Stati membri dell'UE. Segue una valutazione accelerata da parte del Comitato per i medicinali per uso umano (CHMP) dell'Agenzia europea per i medicinali, annunciata il 24 aprile 2015. L'approvazione si è basata sullo studio CheckMate-066 che ha dimostrato più alto sopravvivenza globale rispetto a dacarbazina nell'impostazione di prima linea e lo studio CheckMate-037 che mostra una risposta migliore rispetto a chemioterapia in pazienti precedentemente trattati.
Nel luglio 2018, la Commissione europea (CE) ha approvato nivolumab per il trattamento aggiuntivo di pazienti adulti con melanoma con coinvolgimento linfonodale o malattia metastatica sottoposti a resezione completa. Questa indicazione è per BRAF mutante e pazienti con melanoma wild-type. Con questa decisione, nivolumab diventa la prima e unica terapia PD-1 a ricevere l'approvazione CE in ambito adiuvante. L'approvazione si è basata sui risultati della fase 3 randomizzata in corso, doppio cieco CheckMate-238 test.
Nivolumab è disponibile in Nuova Zelanda ed è finanziato da PHARMAC per alcuni casi di melanoma metastatico avanzato non resecabile.
Come funziona nivolumab?
- Il percorso PD-1 funge da punto di controllo per limitare Cellula T.–Risposte immunitarie mediate.
- Cancro Le cellule possono trarre vantaggio da percorsi "regolatori", come percorsi di checkpoint, per nascondersi dal sistema immunitario e proteggere il tumore attacco immunitario.
- Entrambi i ligandi PD-1, PD-L1 (ligando del recettore di morte programmata 1) e PD-L2, attivano il recettore PD-1 e inducono la segnalazione PD-1 e la "deplezione" associata delle cellule T, un inibizione attivazione delle cellule T e proliferazione.
- L'interazione PD-L1 / PD-1 inibisce l'attivazione immunitaria e riduce le cellule T. citotossico attività quando richiesto.
- Questo ciclo di feedback negativo è essenziale per mantenere le normali risposte immunitarie e limita l'attività delle cellule T per proteggere le cellule normali durante cronica infiammazione.
- Le cellule tumorali possono aggirare la citotossicità mediata dalle cellule T esprimendo PD-L1 nel tumore stesso o nell'infiltrazione del tumore cellule immunitarie, con conseguente inibizione della distruzione delle cellule tumorali immuno-mediata.
- L'espressione anormale di PD-L1 sulla superficie delle cellule di melanoma attiva PD-1 e sopprime l'attività delle cellule T citotossiche.
- Questa tolleranza delle cellule T consente alle cellule tumorali di evitare il riconoscimento e l'attacco del sistema immunitario.
- Nivolumab è un umanizzato altamente selettivo. monoclonale Anticorpo IgG4 che si lega al recettore del checkpoint PD-1 all'attivazione Cellule T.. e ne blocca l'interazione con PD-L1 e PD-L2, rilasciando l'inibizione della risposta immunitaria contro le cellule tumorali mediate dalla via PD-1.
Come viene somministrato nivolumab?
- Nivolumab viene somministrato per via endovenosa alla dose di 3 mg / kg ogni 2 settimane e viene infuso nell'arco di 1 ora.
- Il trattamento viene continuato fino a quando la malattia progredisce o è inaccettabile. tossicità.
- Per nivolumab in combinazione con ipilumab, nivolumab deve essere somministrato per primo, seguito dall'infusione di ipilimumab.
- La dose raccomandata di nivolumab nella fase di associazione è di 1 mg / kg somministrata per via endovenosa nell'arco di 60 minuti ogni 3 settimane per le prime 4 dosi in associazione con ipilumab 3 mg / kg somministrata per via endovenosa nell'arco di 90 minuti. Questo dovrebbe essere seguito dalla monoterapia con nivolumab.
- Nivolumab e ipilumab devono essere somministrati e monitorati sotto la supervisione di medici esperti nell'uso dell'immunoterapia.
- Quando OPDIVO viene somministrato in combinazione con YERVOY (ipilimumab), se uno dei due agenti viene interrotto, anche l'altro deve essere interrotto.
Modifiche della dose
- Ipotiroidismo o ipertiroidismo: nessuna modifica della dose raccomandata.
- Renale deterioramento: non sono necessarie modifiche della dose.
- Blando epatica deterioramento: non sono necessarie modifiche della dose.
- Compromissione epatica moderata o grave: non sono disponibili studi.
Interrompi il trattamento per una qualsiasi delle seguenti condizioni
- Grado 2 polmonite
- Grado 2 o 3 colite
- AST o ALT > 3-5 x limite normale superiore (UNL) o totale bilirubina > 1,5-3 x UNL
- Siero creatinina> 1,5-6 x UNL o> 1,5 volte base
- Qualsiasi altro grado 3 correlato o trattamento serio Reazioni avverse
- Il trattamento può essere ripreso nei pazienti le cui reazioni avverse raggiungono il grado 0-1.
Sospendi definitivamente in una delle seguenti condizioni
- Qualsiasi reazione avversa pericolosa per la vita o di grado 4
- Polmonite di grado 3 o 4
- Colite di grado 4
- AST o ALT> 5 x UNL o bilirubina totale> 3 x UNL
- Creatinina sierica> 6 x UNL
- Qualsiasi trattamento serio o di grado 3 reazione avversa che si ripete
- Incapacità di ridurre corticosteroide dose a ≤ 10 mg / die di prednisone o equivalente in 12 settimane
- Persistente Reazioni avverse di grado 2 o 3 correlate al trattamento che non raggiungono il grado 0-1 entro 12 settimane dall'ultima dose.
Collegamento alle prove chiave degli studi clinici su nivolumab
Possibili interazioni farmacologiche con nivolumab
- Non formale farmacocinetica Sono stati condotti studi di interazione farmacologica con nivolumab.
- Nivolumab è un anticorpo monoclonale umano e come tale non è metabolizzato dal citocromo P450 (CYP). enzimi o altri enzimi che metabolizzano i farmaci. Inibizione o induzione di questi enzimi per somministrazione concomitante di farmaci non dovrebbe influenzare il farmacocinetica di nivolumab.
Quali sono gli effetti avversi di nivolumab?
Negli studi clinici quanto segue eventi avversi sono stati osservati in a incidenza > 10%: aumentato alanina aminotransferasi (28%), iponatriemia (25%), aumento dell'alcalinità fosfatasi (22%), eruzione (21%), prurito (19%), tosse (17%), aumento dell'ALT (16%), iperkaliemia (15%), tratto respiratorio superiore infezione (11%).
Altri eventi avversi clinicamente importanti che si verificano con un'incidenza da 1 a 10% includono:
- Patologie cardiache: ventricolare aritmia
- Patologie dell'occhio: iridociclite.
- Reazioni correlate all'infusione
- Disturbi immuno-mediati: polmonite grave o interstitial malattia polmonare, colite, epatite, nefrite e disturbi della tiroide
- Negli studi clinici, le reazioni avverse immuno-correlate si sono verificate più frequentemente quando nivolumab è stato somministrato in combinazione con ipilimumab rispetto a nivolumab da solo.
- La maggior parte delle reazioni avverse immuno-correlate è migliorata o risolta con un trattamento appropriato, compreso l'inizio di corticosteroidi e modifiche della dose.
Uno studio clinico sulla combinazione di nivolumab e ipilimumab ha interrotto il 36% a causa di effetti collaterali, principalmente diarrea e test di funzionalità epatica elevati.
Cutaneo effetti collaterali di nivolumab
Le complicanze cutanee sono comuni nei pazienti trattati con nivolumab e circa 40% dei pazienti le sperimentano, con metà l'inizio dell'eruzione avviene circa 10 mesi dopo l'inizio del trattamento. Le reazioni riportate includono:
- Morbilliform eruzione
- Prurito
- Lichene eruzione
- Psoriasi
- Eczema
- Vitiligine e poliosi (sbiancamento di capelli)
- Stomatite
- Bolloso pemfigoide
- Sarcoid granuloma
- Cheratoacantomi multipli.
L'oscuramento dei capelli è stato segnalato in alcuni pazienti che assumevano PD-1 inibitori per il cancro del polmone non a piccole cellule [1].
Vedi anche Effetti avversi cutanei di inibitori del checkpoint.
Segnalazione di sospette reazioni avverse
Per il monitoraggio continuo del rapporto rischi / benefici di nivolumab, gli operatori sanitari sono invitati a segnalare qualsiasi reazione avversa sospetta al New Zealand Center for Pharmacovigilance.
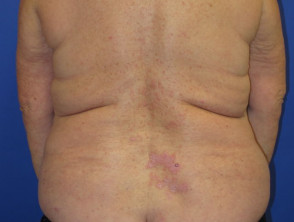
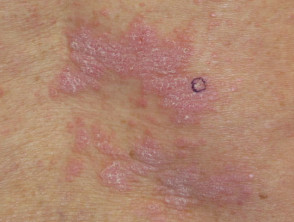
Dermatite lichenoide indotta da nivolumab
Dermatite lichenoide indotta da nivolumab
Dermatite lichenoide indotta da nivolumab
Uso di nivolumab durante la gravidanza
- Incidenze di malformazioni e la perdita di gravidanza nelle gravidanze umane non è stata stabilita per nivolumab.
- Nivolumab deve essere usato durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto.
- Negli studi sulla riproduzione animale, somministrazione a scimmie cynomolgus dall'inizio di organogenesi durante il parto ha provocato un aumento degli aborti spontanei e della morte prematura del feto.
- È noto che le IgG4 umane attraversano la barriera placentare e nivolumab è un IgG4; pertanto, nivolumab ha il potenziale per essere trasmesso dalla madre a sviluppando feto.
- È probabile che gli effetti di nivolumab siano maggiori durante il secondo e il terzo trimestre di gravidanza; non sono disponibili dati sull'uomo per informare sul rischio associato al farmaco.
Uso di nivolumab nelle madri che allattano
- Non è noto se nivolumab o il suo metaboliti sono presenti nel latte materno.
- Consigliare alle donne di interrompere l'allattamento al seno durante il trattamento.
Pediatrico uso di nivolumab
La sicurezza e l'efficacia di nivolumab nei pazienti pediatrici non sono state stabilite. Nivolumab non deve essere usato nei bambini di età inferiore a 18 anni.
Uso geriatrico di nivolumab
Gli studi clinici di nivolumab non includevano un numero sufficiente di pazienti di età pari o superiore a 65 anni per determinare se rispondessero in modo diverso dai pazienti più giovani. Non ci sono differenze generali in termini di sicurezza o efficacia sono stati segnalati tra pazienti anziani (≥ 65 anni) e pazienti più giovani (<65 años). No se requiere ajuste de dosis para pacientes de edad avanzada (≥ 65 años).
Insufficienza renale e nivolumab
Sulla base di un'analisi farmacocinetica di popolazione, non è raccomandato alcun aggiustamento della dose nei pazienti con insufficienza renale.
Insufficienza epatica e nivolumab
Sulla base di un'analisi farmacocinetica di popolazione, non è raccomandato alcun aggiustamento della dose per i pazienti con compromissione epatica lieve. Nivolumab non è stato studiato in pazienti con insufficienza epatica moderata o grave.