Wat is nivolumab?
Nivolumab (OPDIVO®, Bristol Myers Squibb, NJ, VS) is een geprogrammeerde menselijke dood ontvanger-1 (PD-1) -slot antilichaam, goedgekeurd voor geavanceerde behandeling melanoma.
Waar wordt nivolumab voor gebruikt?
In december 2014 keurde de Amerikaanse Food and Drug Administration (FDA) nivolumab goed voor gebruik bij:
- Patiënten met inoperabel of metastatisch melanoom en ziekteprogressie na behandeling met ipilimumab (Yervoy®)
- BRAF V600 mutatie melanoom-positieve patiënten met ziekteprogressie ondanks behandeling met ipilimumab en a BRAF remmer (bijvoorbeeld vemurafenib of dabrafenib).
In oktober 2015 werd nivolumab goedgekeurd voor gebruik in combinatie met ipilimumab om de respons bij gevorderd melanoom (inoperabele of gemetastaseerde ziekte) te verbeteren. In januari 2016 werd het ook goedgekeurd voor onbehandeld BRAF-wildtype melanoom. In december 2017 keurde de FDA nivolumab goed voor assistent behandeling van patiënten met melanoom en betrokkenheid van lymfe knooppunten of uitgezaaide ziekte die heeft ondergaan resectie.
In de Europese Unie heeft het Europees Geneesmiddelenbureau (EMA) de aanvraag voor een vergunning voor het in de handel brengen van nivolumab bij melanoom in een gevorderd stadium gevalideerd voor beoordeling. De aanvraag is ook versneld beoordeeld door het CHMP (Committee for Medicinal Products for Human Use) van de EMA. Nivolumab is beschikbaar in Nieuw-Zeeland en wordt gefinancierd door PHARMAC voor sommige gevallen van niet-reseceerbaar, gemetastaseerd gevorderd melanoom.
In juni 2014 keurde de Europese Commissie nivolumab goed voor PD-1-immuniteit checkpoint-remmer, voor de behandeling van gevorderd (inoperabel of gemetastaseerd) melanoom bij volwassenen, ongeacht de BRAF-status. Dankzij de goedkeuring mag nivolumab in alle 28 EU-lidstaten op de markt worden gebracht. Het volgt op een versnelde evaluatie door het Comité voor geneesmiddelen voor menselijk gebruik (CHMP) van het Europees Geneesmiddelenbureau, die op 24 april 2015 werd aangekondigd. De goedkeuring was gebaseerd op de CheckMate-066-studie die aantoonde hoger totale overleving vs. dacarbazine in de eerstelijnssetting en de CheckMate-037-studie toonde een betere respons vs. chemotherapie bij eerder behandelde patiënten.
In juli 2018 keurde de Europese Commissie (EC) nivolumab goed voor de adjuvante behandeling van volwassen patiënten met een melanoom met aantasting van de lymfeklieren of een gemetastaseerde ziekte die een volledige resectie hebben ondergaan. Deze indicatie is voor BRAF mutant en patiënten met wildtype melanoom. Met deze beslissing wordt nivolumab de eerste en enige PD-1-therapie die CE-goedkeuring krijgt in de adjuvante setting. De goedkeuring was gebaseerd op de resultaten van de lopende gerandomiseerde fase 3, dubbelblind Probeer CheckMate-238.
Nivolumab is beschikbaar in Nieuw-Zeeland en wordt gefinancierd door PHARMAC voor sommige gevallen van niet-reseceerbaar, gemetastaseerd gevorderd melanoom.
Hoe werkt nivolumab?
- Het PD-1-pad dient als een controlepunt om te beperken T-cel- Immuungemedieerde reacties.
- Kanker Cellen kunnen profiteren van "regulerende" routes, zoals checkpoint-routes, om zich voor het immuunsysteem te verbergen en de tumor van een immuunaanval.
- Beide PD-1-liganden, PD-L1 (programmed death receptor ligand 1) en PD-L2, activeren de PD-1-receptor en induceren PD-1-signalering en bijbehorende T-cel "burn-out", een remming T-cel activatie en proliferatie.
- PD-L1/PD-1-interactie remt immuunactivatie en vermindert T-cellen cytotoxisch activiteit wanneer nodig.
- Deze negatieve feedbacklus is essentieel om normale immuunresponsen te behouden en beperkt de T-celactiviteit om normale cellen te beschermen tijdens chronisch ontsteking.
- Tumorcellen kunnen T-cel-gemedieerde cytotoxiciteit omzeilen door PD-L1 tot expressie te brengen in de tumor zelf of in tumorinfiltratie immune cellen, resulterend in remming van het door het immuunsysteem gemedieerde doden van tumorcellen.
- Abnormale expressie van PD-L1 op het oppervlak van melanoomcellen activeert PD-1 en onderdrukt cytotoxische T-celactiviteit.
- Door deze T-celtolerantie kunnen tumorcellen herkenning en aanval door het immuunsysteem vermijden.
- Nivolumab is een zeer selectieve gehumaniseerde. monoklonaal IgG4-antilichaam dat zich bij activatie bindt aan de PD-1 checkpoint-receptor T-cellen. en blokkeert hun interactie met PD-L1 en PD-L2, waardoor de remming van de immuunrespons tegen tumorcellen, gemedieerd door de PD-1-route, wordt opgeheven.
Hoe wordt nivolumab toegediend?
- Nivolumab wordt intraveneus toegediend in een dosis van 3 mg/kg om de 2 weken en wordt via een infuus van 1 uur toegediend.
- De behandeling wordt voortgezet totdat de ziekte voortschrijdt of onaanvaardbaar is. toxiciteit.
- Voor nivolumab in combinatie met ipilumab moet eerst nivolumab worden toegediend, gevolgd door ipilimumab-infusie.
- De aanbevolen dosis nivolumab in de combinatiefase is 1 mg/kg intraveneus toegediend gedurende 60 minuten elke 3 weken voor de eerste 4 doses in combinatie met ipilumab 3 mg/kg intraveneus toegediend gedurende 90 minuten. Dit moet worden gevolgd door monotherapie met nivolumab.
- Nivolumab en ipilumab moeten worden toegediend en gecontroleerd onder toezicht van artsen die ervaring hebben met het gebruik van immunotherapie.
- Als OPDIVO wordt toegediend in combinatie met YERVOY (ipilimumab), moet, als een van de middelen wordt stopgezet, ook met het andere worden gestopt.
Dosisaanpassingen
- hypothyreoïdie of hyperthyreoïdie: Geen aanbevolen dosisaanpassingen.
- nier verslechtering: geen dosisaanpassingen vereist.
- Mild lever verslechtering: geen dosisaanpassingen vereist.
- Matige of ernstige leverfunctiestoornis: geen studies beschikbaar.
Stop met medicatie voor een van de volgende aandoeningen
- Graad 2 longontsteking
- Graad 2 of 3 colitis
- AST of ALT > 3-5 x bovengrens van normaal (UNL) of totaal bilirubine > 1,5-3 x UNL
- Serum creatinine > 1,5-6 x UNL of > 1,5 maal baseren
- Elke andere ernstige of graad 3-gerelateerde behandeling Bijwerkingen
- De behandeling kan worden hervat bij patiënten bij wie de bijwerkingen herstellen tot graad 0-1.
Definitief opschorten onder een van de volgende voorwaarden
- Elke levensbedreigende of graad 4 bijwerking
- Graad 3 of 4 pneumonitis
- graad 4 colitis
- AST of ALT > 5 x UNL of totaal bilirubine > 3 x UNL
- Serumcreatinine > 6 x UNL
- Elke ernstige of graad 3-behandeling tegengestelde reactie dat wordt herhaald
- onvermogen om te verminderen corticosteroïde dosis van ≤ 10 mg/dag prednison of equivalent in 12 weken
- Aanhoudend Behandelingsgerelateerde bijwerkingen van graad 2 of 3 die niet binnen 12 weken na de laatste dosis herstellen tot graad 0-1.
Link naar belangrijk bewijs uit klinische onderzoeken naar nivolumab
Potentiële geneesmiddelinteracties met nivolumab
- niet formeel farmacokinetiek Er zijn geneesmiddeleninteractiestudies uitgevoerd met nivolumab.
- Nivolumab is een humaan monoklonaal antilichaam en wordt als zodanig niet gemetaboliseerd door cytochroom P450 (CYP). enzymen of andere enzymen die geneesmiddelen metaboliseren. remming of inductie van deze enzymen door gelijktijdige toediening van geneesmiddelen zal naar verwachting geen invloed hebben op de farmacokinetiek van nivolumab.
Wat zijn de bijwerkingen van nivolumab?
In klinische onderzoeken het volgende bijwerkingen zijn waargenomen in een incidentie > 10%: verhoogd alanine aminotransferase (28%), hyponatriëmie (25%), verhoogde alkaliteit fosfatase (22%), uitslag (21%), jeuk (19%), hoest (17%), ALAT verhoogd (16%), hyperkaliëmie (15%), bovenste luchtwegen infectie (11%).
Andere klinisch belangrijke bijwerkingen die optreden met een incidentie van 1 tot 10% zijn:
- Hartaandoeningen: ventriculair aritmie
- Oogaandoeningen: iridocyclitis.
- Infusiegerelateerde reacties
- Immuungemedieerde aandoeningen: ernstige longontsteking of interstitiële longziekte, colitis, hepatitis, nefritis en schildklieraandoeningen
- In klinische onderzoeken zijn immuungerelateerde bijwerkingen vaker voorgekomen wanneer nivolumab werd toegediend in combinatie met ipilimumab dan wanneer nivolumab alleen werd toegediend.
- De meeste immuungerelateerde bijwerkingen verbeterden of verdwenen met de juiste behandeling, waaronder het starten van corticosteroïden en dosisaanpassingen.
Een klinische proef met de combinatie van nivolumab en ipilimumab had 36% ingetrokken vanwege bijwerkingen, voornamelijk diarree en verhoogde leverfunctietesten.
huid bijwerkingen van nivolumab
Cutane complicaties komen vaak voor bij patiënten die met nivolumab worden behandeld, en ongeveer 40% van de patiënten ervaart ze, met voor de helft het begin van de huiduitslag treedt ongeveer 10 maanden na aanvang van de behandeling op. Gerapporteerde reacties omvatten:
- morbilliform uitslag
- pruritus
- lichenoïde uitslag
- Psoriasis
- Eczeem
- vitiligo en poliose (bleken van haar)
- stomatitis
- bulleus pemfigoïd
- sarcoïde granuloom
- Meerdere keratoacanthoma's.
Donker worden van het haar is gemeld bij sommige patiënten die PD-1 gebruikten remmers voor niet-kleincellige longkanker [1].
Zie ook Cutane bijwerkingen van checkpoint-remmers.
Melding van vermoedelijke bijwerkingen
Voor voortdurende monitoring van de balans tussen voordelen en risico's van nivolumab, worden beroepsbeoefenaren in de gezondheidszorg aangemoedigd om vermoedelijke bijwerkingen te melden aan het New Zealand Pharmacovigilance Centre.
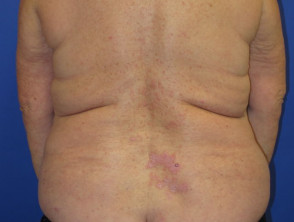
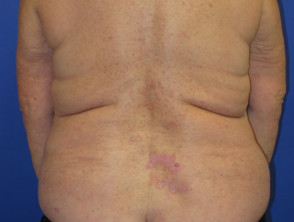
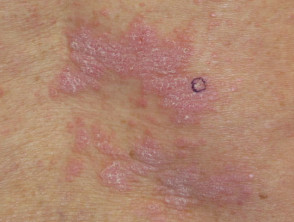
Nivolumab-geïnduceerde lichenoïde dermatitis
Nivolumab-geïnduceerde lichenoïde dermatitis
Nivolumab-geïnduceerde lichenoïde dermatitis
Gebruik van nivolumab tijdens de zwangerschap
- De incidenten van misvormingen en zwangerschapsverlies bij menselijke zwangerschappen is niet vastgesteld voor nivolumab.
- Nivolumab mag alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel opweegt tegen het potentiële risico voor de foetus.
- In voortplantingsstudies bij dieren, toediening aan cynomolgus apen vanaf het begin van organogenese tijdens de bevalling resulteerde in een toename van miskramen en voortijdige dood van de foetus.
- Van humaan IgG4 is bekend dat het de placenta passeert en nivolumab is een IgG4; daarom kan nivolumab van moeder op kind worden overgedragen. ontwikkelen foetus.
- De effecten van nivolumab zijn waarschijnlijk het grootst tijdens het tweede en derde trimester van de zwangerschap; Er zijn geen gegevens over de mens beschikbaar om het risico van het medicijn te informeren.
Gebruik van nivolumab bij moeders die borstvoeding geven
- Het is niet bekend of nivolumab of zijn metabolieten aanwezig zijn in de moedermelk.
- Adviseer vrouwen tijdens de behandeling te stoppen met borstvoeding.
pediatrisch gebruik van nivolumab
De veiligheid en werkzaamheid van nivolumab bij pediatrische patiënten zijn niet vastgesteld. Nivolumab mag niet worden gebruikt bij kinderen jonger dan 18 jaar.
Geriatrisch gebruik van nivolumab
Klinische onderzoeken met nivolumab omvatten niet een voldoende aantal patiënten van 65 jaar of ouder om te bepalen of zij anders reageren dan jongere patiënten. Er zijn geen algemene verschillen in veiligheid of effectiviteit werden gemeld bij oudere patiënten (≥ 65 jaar) en jongere patiënten (<65 años). No se requiere ajuste de dosis para pacientes de edad avanzada (≥ 65 años).
Nierfalen en nivolumab
Op basis van een populatie-farmacokinetische analyse wordt geen dosisaanpassing aanbevolen bij patiënten met nierinsufficiëntie.
Leverfalen en nivolumab
Op basis van een populatie-farmacokinetische analyse wordt geen dosisaanpassing aanbevolen voor patiënten met een lichte leverfunctiestoornis. Nivolumab is niet onderzocht bij patiënten met matige of ernstige leverinsufficiëntie.