Terminologie des unteren anogenitalen Plattenepithels
Einleitung Auf dieser Seite wird die Entwicklung der Terminologie beschrieben, die zur Beschreibung des Zustands verwendet wurde, der früher als vulvärer intraepithelialer Zustand bekannt war. Neoplasie (VIN). Im Jahr 2015 hat die International Society for the Study of Vulvovaginal Disease (ISSVD) den Begriff vulväre (vulväre) Plattenepithelläsion (SIL) eingeführt. Wenn Sie in dieser Liste nicht finden, wonach Sie suchen, probieren Sie unser Glossar, Index […]
Pembrolizumab

Ad Skin Cancer-Anwendung zur Erleichterung der Selbstuntersuchung und Früherkennung der Haut. Mehr lesen. Text: Miiskin Was ist Pembrolizumab? Pembrolizumab (früher bekannt als Lambrolizumab; Handelsname Keytruda®) ist ein von Merck and Co (New Jersey, USA) vertriebenes Medikament, das auf den programmierten Zelltod-1-Rezeptor (PD-1) abzielt. Er […]
Wichtige Beweise aus klinischen Studien für Vismodegib
Einleitung Die Zulassung von Vismodegib basierte auf den Ergebnissen der ERIVANCE-Zulassungsstudie zum Basalzellkarzinom (BCC). ERIVANCE BCC war eine internationale, einarmige, multizentrische, offene Phase-II-Studie mit zwei Kohorten, an der 104 Patienten mit fortgeschrittenem BCC, einschließlich lokal fortgeschrittenem BCC (n=71) und metastasiertem BCC, teilnahmen.
Wichtige Beweise aus klinischen Studien für Trametinib
Einleitung Am 29. Mai 2013 hat die US-amerikanische Food and Drug Administration (FDA) Trametinib (MEKINIST™-Tabletten, GlaxoSmithKline, USA) als orale Einzelwirkstoffbehandlung für Patienten mit nicht entzündlichen Erkrankungen zugelassen. operables Melanom (Melanom, das nicht behandelt werden kann). durch eine Operation entfernt) oder metastasiertes Melanom (Melanom, das […]
Wichtige Beweise aus klinischen Studien für Sonidegib
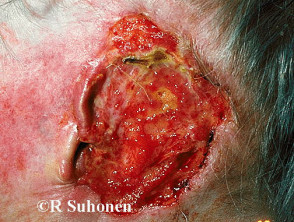
Einleitung Im Juli 2015 hat die US-amerikanische Food and Drug Administration (FDA) Sonidegib (Odomzo®; Novartis, New Jersey, USA) für die Behandlung von erwachsenen Patienten mit Basalzellkarzinom (BCC) zugelassen. Die Europäische Kommission hat die Anwendung von Sonidegib bei Basalzellkarzinom im August 2015 genehmigt. Im Juni […]
Wichtige Beweise aus klinischen Studien für Lanadelumab
Einleitung Im August 2018 hat die US-amerikanische Food and Drug Administration (FDA) Lanadelumab (Handelsname Takhzyro™) zur Prävention hereditärer Angioödem-Attacken bei Patienten ≥ 12 Jahren zugelassen. Dieses Medikament wurde von der FDA im Rahmen ihrer vorrangigen Prüfung bewertet, die Medikamenten vorbehalten ist, die erhebliche Verbesserungen bei […] darstellen.
Wichtige Beweise aus klinischen Studien für Ixekizumab
Einleitung Ixekizumab (Taltz®) ist ein humanisierter monoklonaler Immunglobulin-G-Antikörper, der von Eli Lilly and Company entwickelt wurde und in den USA (März 2016) und Europa (April 2016) zur Behandlung von Plaque-Psoriasis zugelassen wurde. Ixekizumab ist ein Inhibitor von Interleukin-17A (IL-17A), einem entzündungsfördernden Zytokin, das bei der Entstehung verschiedener Erkrankungen eine Rolle spielt […]
Wichtige Beweise aus klinischen Studien für Ingenol-Mebutat-Gel
30. Januar 2020 – Großbritannien und Europa setzen die Vermarktung von Picato® Gel aus. Die Regulierungsbehörde für Arzneimittel und Gesundheitsprodukte des Vereinigten Königreichs [1] und die Europäische Arzneimittelbehörde (EMA) [2] haben bekannt gegeben, dass die Vermarktung von Picato®-Gel mit Ingenolmebutat ausgesetzt wurde. Sie haben empfohlen, dass Patienten […]
Wichtige Beweise aus klinischen Studien für Guselkumab
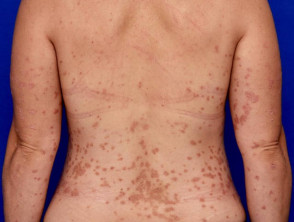
Einleitung Im Juli 2017 hat die US-amerikanische Food and Drug Administration (FDA) Guselkumab (Tremfya™; Janssen Biotech, PA, USA) für die Behandlung von Erwachsenen mit Symptomen einer mittelschweren bis schweren Plaque-Psoriasis zugelassen, die für eine systemische Therapie oder Phototherapie in Frage kommen. Guselkumab ist die erste und einzige zugelassene biologische Therapie […]
Wichtige Beweise aus klinischen Studien für Dabrafenib
Was ist Dabrafenib? Dabrafenib ist oral bioverfügbar. Inhibitor des mutierten BRAF-Proteins bei Patienten mit Melanom. Am 29. Mai 2013 hat die US-amerikanische Food and Drug Administration (FDA) Dabrafenib (TAFINLAR™-Kapsel, GlaxoSmithKline, LLC) für die Behandlung von Patienten mit inoperablem oder metastasiertem Melanom zugelassen.
