Was ist Cemiplimab?
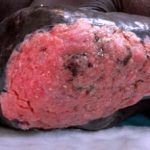
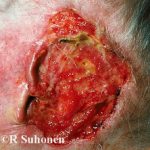
Cemiplimab (auch Cemiplimab-rwlc genannt; Markenname Libtayo®; Regeneron Pharmaceuticals Inc., New York, USA) ist ein monoklonal Antikörper verwendet für Patienten mit fortgeschrittenem Haut- schuppig Zelle Karzinom (SCC).
Cemiplimab wurde von der US-amerikanischen Food and Drug Administration (FDA) für Patienten mit zugelassen metastatisch Kutanes SCC oder lokal fortgeschrittenes kutanes SCC, die keine Kandidaten für eine kurative Operation oder kurative Bestrahlung sind.
Cemiplimab wurde von der FDA im Rahmen einer vorrangigen Prüfung bewertet, die Arzneimitteln vorbehalten ist, die eine signifikante Verbesserung der Sicherheit darstellen oder darstellen Wirksamkeit bei der Behandlung schwerer Krankheiten.
Cemiplimab ist die erste und einzige Behandlung, die speziell für fortgeschrittenes kutanes SCC in den USA zugelassen und verfügbar ist. Regeneron und Sanofi-Aventis (New Jersey, USA) werden Cemiplimab in den USA gemeinsam vermarkten. Cemiplimab gehört zu einer Klasse von Wirkstoffen, die als Immunwirkstoffe bekannt sind Steuerung Inhibitoren, die wirken, indem sie die körpereigene Immunantwort auf Tumore stärken.
Im April 2018 hat die Europäische Arzneimittel-Agentur (EMA) den Zulassungsantrag für Cemiplimab zur Behandlung von Patienten mit metastasiertem kutanem SCC oder lokal fortgeschrittenem SCC, die nicht für eine Operation in Frage kommen, zur Prüfung angenommen.
Der EMA-Überprüfungsprozess wird voraussichtlich in der ersten Hälfte des Jahres 2019 abgeschlossen sein. Derzeit gibt es keine von der EMA zugelassenen Behandlungen für fortgeschrittenes kutanes SCC. Derzeit werden Zulassungsanträge auch in anderen Ländern geprüft.
Cemiplimab ist derzeit in Neuseeland nicht erhältlich.
Nachweise aus klinischen Studien für Cemiplimab
Wichtigste Ergebnisse des klinischen Programms für fortgeschrittenes kutanes SCC
Die FDA-Zulassung von Cemiplimab basierte auf einer gepoolten Analyse von Daten aus a öffnen, multizentrisch, neinzufällig Phase-II-Studie bekannt als EMPOWER-CSCC-1 (Studie 1540) und zwei Expansionskohorten mit fortgeschrittenem kutanem SCC aus einer multizentrischen, offenen, nicht randomisierten Phase-I-Studie (Studie 1423). Zusammen stellten diese Studien den größten prospektiven Datensatz zu fortgeschrittenem kutanem SCC dar.
Die wichtigsten Wirksamkeitsindikatoren für EMPOWER-CSCC-1 und die beiden SCC-Hautexpansionskohorten waren die bestätigte objektive Ansprechrate (ORR), die von einem unabhängigen zentralen Review (ICR) bewertet wurde, und die Dauer des Ansprechens, die vom ICR bewertet wurde.
Für Patienten mit metastasiertem kutanem SCC ohne äußerlich sichtbares Ziel Verletzungen, ORR wurde unter Verwendung der Response-Evaluierungskriterien in bestimmt Solide Tumore (RECIST 1.1). Für Patienten mit äußerlich sichtbarem Zielverletzungen (lokal fortgeschrittenes und metastasiertes kutanes SCC) wurde die ORR unter Verwendung eines zusammengesetzten Endpunkts bestimmt, der ICR-Bewertungen von integrierte radiologisch Daten (RECIST 1.1) und digitale medizinische Fotografie (Kriterien der Weltgesundheitsorganisation).
Die Wirksamkeitsanalyse wurde durchgeführt, als alle Patienten die Gelegenheit für eine Nachbeobachtung von mindestens 6 Monaten hatten.
Die Patienten erhielten Cemiplimab 3 mg/kg intravenös alle 2 Wochen für bis zu 48 Wochen in Studie 1423 oder bis zu 96 Wochen in Studie 1540. Die Behandlung wurde bis zum Fortschreiten der Krankheit fortgesetzt, inakzeptabel Toxizitätoder Abschluss der geplanten Behandlung. Tumor Auswertungen des Ansprechens wurden alle 8 Wochen durchgeführt.
Beide Studien schlossen Patienten aus mit:
- Autoimmun Krankheit, die erforderlich ist systemisch Therapie mit Immunsuppressiva innerhalb von 5 Jahren
- Eine solide Orgelgeschichte Transplantation
- Vorherige Behandlung mit antiprogrammiertem Zelltod Protein Ligandenblockade 1 (PD-1) / programmierter Tod 1 (PD-L1) Antikörper oder andere immun Steuerung Inhibitor Therapien
- Infektion mit HIV
- Hepatitis B oder Hepatitis C
- Ein Leistungsstatus der Eastern Cooperative Oncology Group ≥ 2.
Die gepoolten Wirksamkeitsergebnisse (n = 108) von EMPOWER-CSCC-1 und den zwei Kohorten mit fortgeschrittener kutaner SCC-Expansion aus der Phase-1-Studie sind in der folgenden Tabelle zusammengefasst:
| Wirksamkeitsendpunkte * | Metastasiertes CSCC (n = 75) | Lokal fortgeschrittenes CSCC (n = 33) | Kombiniertes CSCC (n = 108) |
| Bestätigtes objektives Ansprechen (ORR) | |||
| ORR (95% Konfidenzintervall [CI]) | 47% (35, 59) |
49% (31,67) |
47% (38, 57) |
| Vollständige Rücklaufquote† | 5% | 0% | 4% |
| Partielle Rücklaufquote | 41% | 49% | 44% |
| Reaktionsdauer (DOR) | |||
| Reichweite in Monaten | 3–15 + | 1–13 + | 1-15 + |
| Patienten mit DR > 6 Monate, n (%) | 21 (60%) | 10 (63%) | 31 (61%) |
* Median Nachbeobachtungsdauer: metastasiertes HCC: 8,1 Monate; Lokal fortgeschrittenes CSCC: 10,2 Monate; Kombinierter CSCC: 8,9 Monate
† Umfasst Patienten mit vollständiger Heilung einer früheren Hautbeteiligung; Patienten mit lokal fortgeschrittenem CSCC in EMPOWER-CSCC-1 erforderlich Biopsie um die vollständige Antwort zu bestätigen.
Nebenwirkungen
Für die gepoolte Sicherheitsanalyse (n = 163) von EMPOWER-CSCC-1 und den beiden SCC-Kohorten mit fortgeschrittener Hautexpansion waren die am häufigsten berichteten Nebenwirkungen:
- Ermüdung (29%)
- Eruption (25%)
- Durchfall (22%).
Bei 5%-Patienten wurde Cemiplimab aufgrund der folgenden Nebenwirkungen dauerhaft abgesetzt:
- Lungenentzündung
- Autoimmun Myokarditis
- Hepatitis
- Aseptisch Meningitis
- Komplexer regionaler Schmerz Syndrom
- Husten
- Muskelschwäche
Ernst Nebenwirkungen trat bei 28% der Patienten auf. Die SUE, die bei mindestens 2% der Patienten auftraten, waren:
- Cellulitis
- Septikämie
- Lungenentzündung
- Lungenentzündung
- Harnwegsinfekt.
Zu den Nebenwirkungen, die bei weniger als 10% von Patienten mit fortgeschrittenem kutanem SCC auftraten, die in Studie 1423 und Studie 1540 Cemiplimab erhielten, gehören:
- Eruption
- Pruritus
- Durchfall
- Übelkeit
- Verstopfung
- Ermüden
- Bewegungsapparat Schmerzen
- Verminderter Appetit.
Labortest Anomalien
Grad 3 und 4 Labortest Anomalien verschlimmert durch Base bei weniger als 1% der Patienten mit fortgeschrittenem kutanem SCC, die in den unten aufgeführten Studien 1423 und 1540 Cemiplimab erhielten.
Chemie
Anomalien enthalten:
- Erhöhte Aspartat-Transanimase (3%)
- Anstieg des international normalisierten Verhältnisses (2%)
- Hypoalbuminämie (1%).
Hämatologie
Anomalien enthalten:
- Lymphopenie (7%)
- Anämie (2%).
Elektrolyte
Anomalien enthalten:
- Hypophosphatämie (4%)
- Hyponatriämie (3%)
- Hyperkalzämie (1%).
Cemiplimab – Zukunftspotenzial
- Cemiplimab ist eine wichtige neue Immuntherapieoption für Kliniker, um einen erheblichen ungedeckten Bedarf bei Patienten mit fortgeschrittenem kutanem SCC zu decken, die nicht mehr für eine kurative Operation oder Bestrahlung in Frage kommen.
- Das in den Studien beobachtete Sicherheitsprofil von Cemiplimab stimmte mit dem anderer zugelassener Anti-PD-1-Wirkstoffe überein.
- Ergebnisse aus klinischen Studien kamen zu dem Schluss, dass Cemiplimab bei etwa der Hälfte der Patienten mit fortgeschrittenem kutanem SCC ein Ansprechen auslöste.
- Cemiplimab wird derzeit in Phase-III-Studien für verschiedene Indikationen, einschließlich metastasierter nicht-kleinzelliger Lunge, untersucht. Krebs (NSCLC), fortgeschrittenes NSCLC, zervikal Krebs und basal Zellkarzinom.