Was ist Risankizumab?
Risankizumab ist eine biologische Behandlung für Psoriasis, eine Hauterkrankung, bei der sich Hautzellen bilden. schuppig rot Platten, häufig an Ellbogen, Knien und im unteren Rückenbereich zu finden.
Risankizumab ist ein Interleukin IL-23-Antagonist angezeigt für die Behandlung von mittelschweren bis schweren Nummernschild Psoriasis bei Erwachsenen, die Kandidaten für sind systemisch Therapie oder Phototherapie [1].
Risankizumab wurde im April 2019 von der US-amerikanischen Food and Drug Administration (FDA), im März 2019 in Japan und im März 2019 von der Europäischen Union zugelassen. Risankizumab trägt den Handelsnamen Skyrizi ™ [AbbVie Inc., North Chicago, IL, USA] [1]. Im Januar 2020 wurde Risankizumab von der Therapie Goods Administration (TGA) und wurde in das Pharmaceutical Benefits Scheme (PBS) für Patienten mit aufgenommen chronisch Plaque-Psoriasis, die den Qualifikationsrichtlinien entspricht.
Derzeit ist Risankizumab in Neuseeland nicht erhältlich.
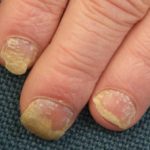
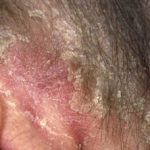
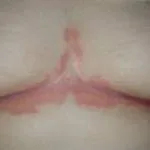
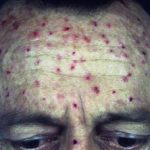
Chronische Plaque-Psoriasis
Chronische Plaque-Psoriasis
Chronische Plaque-Psoriasis
Chronische Plaque-Psoriasis
Wie wirkt Risankizumab?
das entzündungshemmend Zytokin Es wird angenommen, dass IL-23 eine entscheidende Rolle spielt Pathogenese von Psoriasis durch Induzieren und Aufrechterhalten von T-Helferzellen (Th) 17, Th22-Zellen, angeboren lymphoid Zellen und der Effektor Zytokine IL-17, IL-22 und Tumor Nekrose Alpha-Faktor.
Risankizumab gehört zu einer kleinen Gruppe von Humanisierten Immunoglobulin G1 (IgG1) monoklonal Antikörper das Ziel IL-23, das aus zwei Untereinheiten p19 und p40 besteht [2–4].
Das Medikament bindet an die p19-Untereinheit von IL-23 und beeinträchtigt seine Fähigkeit, Psoriasis zu aktivieren und aufrechtzuerhalten. Verletzungen. Die IL-23 / IL-17-Achse wird derzeit als entscheidend für die Pathogenese der Psoriasis angesehen.
Die Aktivierung und Hochregulierung von IL-17 in präpsoriatischer Haut führt zu a entzündlich Antworte in Keratinozyten das treibt die Entwicklung von reifen Psoriasis-Plaques nach Induktion epidermal Hyperplasie und epidermal Proliferation [3,4].
Die p19-Untereinheit ist für IL-23 einzigartig, während die p40-Untereinheit für IL-12 und IL-23 gemeinsam ist.
Die Daten legen nahe, dass IL-23 durch selektiv blockiert wird Hemmung der p19-Untereinheit anstelle von p40 liefert eine vollständigere Hemmung der IL-23-Aktivität, was zu einer erhöhten führt Wirksamkeit bei der Behandlung von Plaque-Psoriasis [4-6].
Wie wird Risankizumab verabreicht?
Die empfohlene Dosis beträgt 150 mg (zwei Injektionen von 75 mg) subkutan Injektion in Woche 0, Woche 4 und danach alle 12 Wochen [7].
Die Injektionen sollten an verschiedenen anatomischen Stellen (wie den Oberschenkeln oder dem Bauch) und nicht in Bereichen verabreicht werden, in denen die Haut zart und verletzt ist. erythematös, schweroder von Psoriasis betroffen.
Kontraindikationen zu Risankizumab
Die Haupt Kontraindikation Risankizumab ist Überempfindlichkeit zum Aktive Substanz oder zu einem der Hilfsstoffe [7].
Warnungen und Vorsichtsmaßnahmen
Rückverfolgbarkeit
Um die Rückverfolgbarkeit von biologischen Arzneimitteln zu verbessern, sollten Name und Chargennummer des verabreichten Risankizumab eindeutig aufgezeichnet werden. [8].
Infektionen
Risankizumab kann das Infektionsrisiko erhöhen, indem es die Fähigkeit des Immunsystems des Patienten verringert, Infektionen zu bekämpfen. In klinischen Studien traten Infektionen bei 22.1% von mit Risankizumab behandelten Patienten auf, verglichen mit 14.7% bei mit Risankizumab behandelten Patienten. Placebo Gruppe bis zu 16 Wochen Behandlung [7].
Die Behandlung mit Risankizumab sollte nicht bei Patienten mit klinisch wichtigen Vorteilen eingeleitet werden. Infektion bis die Infektion behoben oder angemessen behandelt ist.
Bei Patienten mit einer chronischen Infektion oder einer Vorgeschichte von wiederkehrend Berücksichtigen Sie bei der Infektion die Risiken und Vorteile, bevor Sie Risankizumab verschreiben.
Bewertung der Tuberkulose vor der Behandlung
Eine antituberkulöse Therapie sollte vor Beginn der Behandlung mit Risankizumab bei Patienten mit einer Vorgeschichte von in Betracht gezogen werden latent oder aktive Tuberkulose (TB), bei der ein angemessener Behandlungsverlauf nicht bestätigt werden kann. Risankizumab sollte nicht an Patienten mit derzeit aktiver TB verabreicht werden. Die Patienten sollten während und nach der Behandlung mit Risankizumab auf Anzeichen und Symptome einer aktiven Tuberkulose überwacht werden. [7]. (Siehe DermNet NZ-Seite zum TB-Screening.)
Impfungen
Es liegen keine Daten zur Reaktion auf Lebendimpfstoffe oder inaktivierte Impfstoffe vor. Lebendimpfstoffe sollten bei Patienten, die mit Risankizumab behandelt werden, vermieden werden. [7].
Dosisänderung
Patienten mit Nieren- oder hepatisch Behinderung
Es wurden keine spezifischen Studien durchgeführt, um die Auswirkung einer Nieren- oder Leberfunktionsstörung auf die Haut zu bestimmen Pharmakokinetik von Risankizumab [7].
Alte Leute
In klinischen Studien wurden keine allgemeinen Unterschiede in Bezug auf Risankizumab-Exposition, Sicherheit oder Wirksamkeit zwischen älteren und jüngeren Probanden beobachtet. In diesen Studien reichte die Anzahl der Probanden ab 65 Jahren jedoch nicht aus, um festzustellen, ob sie auf jüngere Probanden unterschiedlich reagierten. [7].
Kinder
Die Sicherheit und Wirksamkeit von Risankizumab in pädiatrisch Patienten unter 18 Jahren wurden noch nicht etabliert [7].
Anwendung von Risankizumab in bestimmten Populationen
Schwangere Frau
Es liegen keine Daten zur Anwendung von Risankizumab bei schwangeren Frauen vor, um die mit dem Medikament verbundenen Risiken zu ermitteln. Es ist bekannt, dass IgG die Plazentaschranke überschreitet. Daher kann Risankizumab von der Mutter auf übertragen werden Entwicklung Fötus. Ein erhöhter fetaler Verlust wurde in s berichtetStudien in schwanger Cynomolgus-Affen behandelt mit der 20-fachen empfohlenen Höchstdosis beim Menschen [7].
Stillende Mutter
Es liegen keine Daten zum Vorhandensein von Risankizumab in der Muttermilch, zu den Auswirkungen auf das stillende Kind oder zu den Auswirkungen auf die Milchproduktion vor. das Entwicklung und die gesundheitlichen Vorteile des Stillens müssen gegen mögliche nachteilige Auswirkungen von Risankizumab auf den Säugling abgewogen werden [7].
Kinder
Die Sicherheit und Wirksamkeit von Risankizumab bei Kindern unter 18 Jahren wurde nicht nachgewiesen. [7].
Alte Leute
In klinischen Studien wurden keine allgemeinen Unterschiede in Bezug auf Sicherheit oder Wirksamkeit zwischen Patienten über 65 Jahren und jüngeren Patienten, die mit Risankizumab behandelt wurden, beobachtet. Die Anzahl der Patienten über 65 Jahre reichte jedoch nicht aus, um festzustellen, ob sie auf jüngere Probanden unterschiedlich reagierten. [7].
Übergewichtige und untergewichtige Patienten
Freier Speicherplatz und Volumen von Verteilung Risankizumab erhöht und Plasma Konzentrationen nehmen mit zunehmendem Körpergewicht ab; Es wird jedoch keine Dosisanpassung basierend auf dem Körpergewicht empfohlen [7].
Fruchtbare Männer
Bei geschlechtsreifen männlichen Cynomolgus-Affen wurden keine Auswirkungen auf die männlichen Fertilitätsparameter beobachtet. subkutan 26 Wochen lang einmal wöchentlich mit 50 mg / kg Risankizumab (20-fache empfohlene Dosis) behandelt [7].
Was sind die möglichen Wechselwirkungen mit Risankizumab?
Cytochrom P450 Substrate
Es gab keine klinisch signifikanten Veränderungen bei der Exposition gegenüber Koffein (CYP1A2) Substrat), Warfarin (CYP2C9-Substrat), Omeprazol (CYP2C19-Substrat), Metoprolol (CYP2D6-Substrat) oder Midazolam (CYP3A-Substrat), die bei gleichzeitiger Anwendung von 150 mg Risankizumab subkutan in den Wochen 0, 4, 8 beobachtet wurden und 12 (häufiger als die genehmigte empfohlene Dosierungshäufigkeit) bei Menschen mit Plaque-Psoriasis [7].
Lebendimpfstoffe
Die Verwendung von Lebendimpfstoffen sollte bei Patienten, die mit Risankizumab behandelt werden, vermieden werden. [8]. Diese Impfstoffe umfassen:
- Lebendimpfstoff gegen Influenzaviren (gängige Impfstoffe sind sicher)
- Vierwertiger intranasaler Impfstoff gegen Masern, Mumps und Röteln
- Oraler Rotavirus-Lebendimpfstoff
- Lebendpockenimpfstoff (Vaccinia)
- Lebendtyphus-Impfstoff
- Lebendimpfstoff gegen Windpocken oder Gürtelrose-Virus
- Helles Gelb Fieber Impfstoff.
Was sind die möglichen Nebenwirkungen von Risankizumab?
Das Üblichste unerwünschte Arzneimittelwirkung Bei mehr als 10% von Patienten, die in klinischen Studien Risankizumab erhielten, traten Infektionen der oberen Atemwege auf, die bei 13% von Patienten auftraten [7].
Arzneimittelnebenwirkungen das bei 1 bis 10% von Patienten auftrat, die Risankizumab erhielten, einschließlich [7]:
- Kopfschmerzen (3.5%)
- Müdigkeit (2,5%)
- Reaktionen an der Injektionsstelle (1,5%)
- Ringwurminfektionen (1,1%).
Schwere Infektionen mit weniger als 1% Vorfall als Folge einer Nebenwirkung auf ein enthaltenes Medikament auftreten [7]:
- Cellulitis
- Osteomyelitis
- Septikämie
- Herpesinfektion.