introduzione
Nel luglio 2017, la Food and Drug Administration (FDA) statunitense ha approvato guselkumab (Tremfya ™; Janssen Biotech, PA, USA) per il trattamento di adulti con sintomi da moderati a gravi. targa psoriasi che sono candidati per sistemico terapia o fototerapia. Guselkumab è la prima e unica terapia biologica approvata che blocca solo selettivamente interleuchina (IL) -23, a citochina che svolge un ruolo chiave nella psoriasi a placche.
Guselkumab ha ricevuto l'approvazione della FDA sulla base dei risultati di uno studio clinico. sviluppo programma che ha arruolato più di 2.000 pazienti negli studi di fase III VOYAGE 1, VOYAGE 2 e NAVIGATE.
Nel settembre 2017, il comitato per i medicinali per uso umano (CHMP) dell'Agenzia europea per i medicinali ha adottato un parere positivo raccomandando l'autorizzazione all'immissione in commercio nell'Unione europea per l'uso di guselkumab nel trattamento di adulti con psoriasi a placche moderata. a serio sono candidati. per la terapia sistemica.
Guselkumab non è attualmente disponibile in Nuova Zelanda (a partire da gennaio 2018).
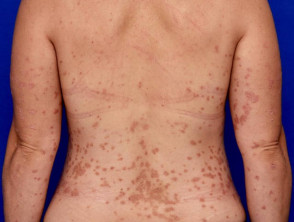
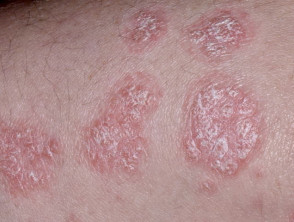
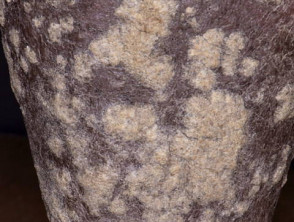
Psoriasi da moderata a grave adatta per guselkumab
Psoriasi moderata sulla schiena
Psoriasi cronica a placche
Psoriasi con squame molto spesse
TRIP 1 e 2 (rispetto a guselkumab placebo o adalimumab)
- Un totale di 1443 pazienti erano randomizzato un guselkumab (100 mg alle settimane 0 e 4 e successivamente ogni 8 settimane), placebo o adalimumab (80 mg alla settimana 0 e 40 mg alla settimana 1, seguiti da 40 mg a settimane alterne successivamente ).
- I pazienti avevano un punteggio IGA (Investigator's Global Assessment) ≥ 3 (moderato) su un punteggio di 5 punti. scala della gravità generale della malattia, un indice di gravità e area della psoriasi (PASI) punteggio ≥ 12 e una superficie corporea minima interessata di 10%.
- Pazienti con guttata, eritrodermica o pustolosa la psoriasi è stata esclusa.
- I due co-primario gli endpoint erano (1) la proporzione di individui che hanno raggiunto un punteggio IGA di 0 (eliminati) o 1 (minimo); e (2) la proporzione di soggetti che hanno ottenuto almeno una riduzione di 90% da base sul punteggio composito PASI (PASI 90).
- Entrambi gli studi VOYAGE 1 e 2 hanno valutato le risposte alla settimana 16 rispetto al placebo per i due endpoint co-primari.
- Efficacia I risultati sono riassunti nella Tabella 1.
Tabella 1. Risultati di efficacia alla settimana 16 negli adulti con psoriasi a placche rispetto al placebo negli studi VOYAGE 1 e 2.
|
VIAGGIO 1 |
VIAGGIO 2 |
|||
|
Variabile principale N. di pazienti (%) |
Guselkumab (n = 329) |
Placebo (n = 174) |
Guselkumab (n = 496) |
Placebo (n = 248) |
|
Risposta IGA di 0/1 |
280 (85) |
12 (7) |
417 (84) |
21 (8) |
|
Risposta PASI 90 |
241 (73) |
5 (3) |
347 (70) |
6 (2) |
IGA, Investigator Global Assessment Score; PASI 90, 901 Riduzione TP1T rispetto al basale nell'area della psoriasi e punteggio composito dell'indice di gravità.
Confronto di guselkumab con adalimumab
La tabella 2 presenta i risultati di un'analisi di tutti i siti nordamericani (USA e Canada) negli studi TRIP 1 e 2, dimostrando la superiorità di guselkumab rispetto ad adalimumab.
Tabella 2. Risultati di efficacia di guselkumab rispetto ad adalimumab nella psoriasi a placche nei siti VOYAGE 1 e 2 in Nord America
|
VIAGGIO 1 |
VIAGGIO 2 |
|||
|
Punto finale N. di pazienti (%) |
Guselkumab (n = 115) |
Adalimumab (n = 115) |
Guselkumab (n = 160) |
Adalimumab (n = 81) |
|
Risposta IgA di 0 (chiara) o 1 (minima) |
||||
|
Settimana 16 |
97 (84) |
70 (61) |
119 (74) |
50 (62) |
|
Settimana 24 |
97 (84) |
62 (54) |
119 (74) |
46 (57) |
|
Settimana 48 |
91 (79) |
62 (54) |
N / A |
N / A |
|
Risposta IGA di 0 (cancellata) |
||||
|
Settimana 24 |
61 (53) |
27 (23) |
76 (48) |
23 (28) |
|
Settimana 48 |
54 (47) |
28 (24) |
N / A |
N / A |
|
Risposta PASI 75 |
||||
|
Settimana 16 |
105 (91) |
80 (70) |
132 (83) |
51 (63) |
|
Risposta PASI 90 |
||||
|
Settimana 16 |
84 (73) |
47 (44) |
102 (64) |
34 (42) |
|
Settimana 24 |
92 (80) |
51 (41) |
113 (71) |
41 (51) |
|
Settimana 48 |
84 (73) |
53 (46) |
N / A |
N / A |
Manutenzione reattiva
Per valutare il mantenimento e la durata della risposta a VOYAGE 2, i pazienti randomizzati a guselkumab alla settimana 0 che hanno risposto a PASI 90 alla settimana 28 sono stati riassegnati in modo casuale a guselkumab ogni 8 settimane o al placebo. Alla settimana 48, 89% dei pazienti che hanno continuato a usare guselkumab hanno mantenuto PASI 90 rispetto a 37% che sono stati riassegnati in modo casuale al placebo.
Risultati riferiti dai pazienti
Secondo il Psoriasis Signs and Symptoms Diary (PSSD) alla settimana 16, i pazienti trattati con guselkumab hanno mostrato maggiori miglioramenti in termini di prurito cutaneo, dolore, bruciore, bruciore e tensione rispetto al placebo, negli studi VOYAGE 1 e 2. Una percentuale più elevata di pazienti trattati con guselkumab rispetto ad adalimumab ha raggiunto una PSSD sintomo punteggio di 0 (nessun sintomo) alla settimana 24, in entrambi gli studi.
Eventi avversi con guselkumab (TRIP 1 e 2)
Poiché gli studi clinici vengono condotti in condizioni molto diverse, evento avverso I tassi osservati negli studi clinici potrebbero non riflettere i tassi visti nella pratica. La Tabella 3 riassume gli eventi avversi comunemente osservati negli studi VOYAGE 1 e 2.
Tabella 3. Eventi avversi che si sono verificati in ≥ 1% di pazienti fino alla settimana 16 negli studi Trip 1 e Trip 2
|
Eventi avversi N. di eventi (% di pazienti) |
Guselkumab (n = 283) |
Adalimumab (n = 196)
|
Placebo (n = 422) No. (%) |
|
Vie respiratorie superiori infezioni |
118 (14,3) |
21 (10,7) |
54 (12,8) |
|
Mal di testa |
38 (4,6) |
2 (1) |
14 (3,3) |
|
Reazioni al sito di iniezione |
37 (4,5) |
15 (7,7) |
12 (2,8) |
|
Artralgia |
22 (2,7) |
4 (2) |
9 (2,1) |
|
Diarrea |
13 (1,6) |
3 (1,5) |
4 (0,9) |
|
Influenza intestinale |
11 (1,3) |
4 (2) |
4 (0,9) |
|
Vasca infezione |
9 (1,1) |
0 |
0 |
|
Herpes simplex infezione |
9 (1,1) |
0 |
2 (0,5) |
Fegato elevato enzimi
Gli enzimi epatici elevati sono stati riportati più frequentemente nel gruppo guselkumab (2.6%) rispetto al gruppo placebo (1.9%). Dei 21 pazienti che hanno riportato un aumento degli enzimi epatici nel gruppo guselkumab, tutti gli eventi tranne uno sono stati di gravità da lieve a moderata e nessuno degli eventi ha portato all'interruzione del farmaco.
Sicurezza fino alla settimana 48
La frequenza degli eventi avversi è stata simile al profilo di sicurezza osservato durante le prime 16 settimane di trattamento.
Studio NAVIGATE (guselkumab rispetto a ustekinumab)
- In questa Fase III, randomizzata, doppio cieco studio, 871 pazienti ricevuti Aperto ustekinumab (45 mg o 90 mg) alle settimane 0 e 4.
- Alla settimana 16, 268 pazienti con una risposta inadeguata a ustekinumab IGA ≥ 2) sono stati randomizzati (in doppio cieco) a guselkumab 100 mg o hanno continuato a ustekinumab. 585 pazienti su 871 (67%) con una risposta IGA di 0 (clear) o 1 (minima) alla settimana 16 hanno continuato con ustekinumab aperto.
- L'endpoint primario era il numero di visite in cui i pazienti randomizzati hanno raggiunto IGA 0/1 e un miglioramento di almeno due gradi dalla settimana 28 alla settimana 40.
- Miglioramento ≥ 90% o 100% in PASI (PASI 90/100) e Dermatologia Indice di qualità della vita (DLQI) sono stati valutati anche un punteggio di 0 o 1.
- il metà Il numero di visite in cui i pazienti hanno ottenuto una risposta IGA di 0 o 1 e un miglioramento di almeno due gradi durante le settimane da 28 a 40 è stato significativamente più alto nel gruppo guselkumab rispetto al gruppo ustekinumab randomizzato (1,5 vs. a 0.7; p <0,001).
- Una percentuale maggiore di pazienti nel gruppo guselkumab rispetto al gruppo ustekinumab ha ottenuto una risposta IGA di 0 o 1 e un miglioramento di almeno due gradi alla settimana 28 e alla settimana 52.
- Una percentuale più elevata di pazienti trattati con guselkumab rispetto a ustekinumab ha raggiunto PASI 90, PASI 100 e un punteggio DLQI di 0 o 1 alla settimana 52.
- Dopo la settimana 16, 64,4% dei pazienti nel gruppo guselkumab e 55,6% del gruppo ustekinumab hanno avuto almeno un evento avverso; le infezioni erano il tipo più frequente di AE.
- Complessivamente, 6,7% (n = 9) dei pazienti nel gruppo guselkumab ha avuto almeno un evento avverso grave rispetto a 4,5% (n = 6) nel gruppo ustekinumab.
- Le tabelle 4 e 5 sono un riepilogo dei risultati chiave e degli EA dello studio NAVIGATE.
Tabella 4. Risultati di efficacia di guselkumab rispetto a ustekinumab in NAVIGATE
|
Parametro di efficacia |
Guselkumab (n = 135) |
Ustekinumab (n = 133) |
Valore P. |
|
Numero medio di visite in cui i pazienti hanno ottenuto una risposta IGA di 0 o 1 e un miglioramento di almeno due gradi (rispetto alla settimana 16) dalla settimana 28 alla settimana 40 |
1,5 |
0,7 |
P≤ 0,001 |
|
Numero medio di visite in cui i pazienti hanno ottenuto una risposta IGA di 0 dalla settimana 28 alla settimana 40 |
0,9 |
0.4 |
P≤ 0,001 |
|
Numero medio di visite in cui i pazienti hanno raggiunto PASI 90 dalla settimana 28 alla settimana 40 |
2.2 |
1.1 |
P ≤ 0,001 |
|
Numero di pazienti con una risposta IGA di 0 o 1 e miglioramento ≥ 2 gradi (rispetto alla settimana 16) alla settimana 28 |
42 |
19 |
P ≤ 0,001 |
|
Numero di pazienti con una risposta PASI 90 alla settimana 28 |
Sessantacinque |
30 |
P ≤ 0,001 |
|
Numero di pazienti con punteggio DLQI> 1 alla settimana 16, |
103 |
105 |
P = 0,002 |
|
Numero di pazienti con un punteggio DLQI di 0 o 1 alla settimana 52 |
40 |
20 |
|
|
Numero di pazienti con un punteggio PSSD> 0 alla settimana 16 |
123 |
126 |
|
|
Numero di pazienti con un punteggio PSSD di 0 alla settimana 52 |
25 |
12 |
P <0.05 |
DLQI, indice dermatologico della qualità della vita; Punteggio di valutazione globale dello sperimentatore; PASI 90, riduzione di 90% dal basale nell'area della psoriasi e punteggio composito dell'indice di gravità; PSSD, sintomi della psoriasi e segni quotidiani.
Tabella 5. Eventi avversi durante le settimane 1-60 in pazienti randomizzati a Guselkumab o Ustekinumab su NAVIGATE
|
Evento avverso N. di eventi (% di pazienti) |
Guselkumab (n = 135) |
Ustekinumab (n = 133) |
|
Infezioni |
57 (41,5%) |
47 (35,3%) |
|
Nasofaringite |
23 (17%) |
23 (17,3%) |
|
Infezioni delle vie respiratorie |
15 (11,1%) |
11 (8,3%) |
|
Reazione al sito di iniezione |
7 (1,1%) |
0 |
|
Evento cardiovascolare |
2 (1,5%) |
1 (0,8%) |
|
Malignità |
2 (1,5%) |
0 |
Guselkumab: potenziale futuro
- Guselkumab ha prodotto dati incoraggianti sull'efficacia e la sicurezza nel trattamento da moderato a grave. cronica psoriasi a placche.
- I risultati degli studi clinici di fase III suggeriscono che si tratti di guselkumab più alto al placebo alla settimana 16 ed è maggiormente in grado di eliminare o quasi eliminare la psoriasi piatti rispetto ad adalimumab. Gli effetti sono stati mantenuti fino alla settimana 48.
- Gli studi di fase III su guselkumab riportano alcuni dei più alti tassi di PASI 90 (alla settimana 16, 73.3% su TRIP 1 e 70.0% su TRIP 2) fino ad oggi. La possibilità che guselkumab ottenga una risposta PASI 90 in pazienti ≥70% suggerisce che guselkumab può avere un impatto positivo significativo sulla qualità della vita del paziente.
- I risultati dello studio NAVIGATE hanno stabilito che guselkumab ha avuto un'efficacia sostanziale negli adulti con psoriasi da moderata a grave ed era più efficace di ustekinumab nei pazienti con una risposta inadeguata a ustekinumab.
- Le possibili ragioni per l'efficacia superiore di guselkumab rispetto a ustekinumab includono il ruolo centrale di IL-23 nel Patogenesi di psoriasi, blocco più forte di IL-23 con guselkumab, dosi più alte e più frequenti di guselkumab e / o risposte Th17 potenziate nel contesto di inibizione di IL-12.
- Il profilo di eventi avversi favorevoli di guselkumab osservato negli studi di fase III suggerisce che l'IL-23 potrebbe essere una citochina più specifica per la psoriasi rispetto ad altre. citochine come tumore necrosi fattore-alfa e IL-17.
- Nel complesso, il targeting dell'IL-23, una citochina chiave che guida varie altre citochine effettrici, può essere responsabile dell'elevata efficacia e delle risposte di lunga durata osservate con guselkumab fino alla settimana 48.
- Sono necessari ulteriori studi a lungo termine per comprendere l'efficacia e la sicurezza a lungo termine di guselkumab.