Invoering
In juli 2017 keurde de Amerikaanse Food and Drug Administration (FDA) guselkumab (Tremfya™; Janssen Biotech, PA, VS) goed voor de behandeling van volwassenen met matige tot ernstige symptomen nummerplaat psoriasis die in aanmerking komen voor systemisch therapie of fototherapie. Guselkumab is de eerste en enige goedgekeurde biologische therapie die alleen selectief blokkeert interleukine (IL)-23, op cytokine die een sleutelrol speelt bij plaque psoriasis.
Guselkumab kreeg FDA-goedkeuring op basis van de resultaten van een klinische studie. ontwikkelen programma waaraan meer dan 2.000 patiënten deelnamen aan de fase III-studies VOYAGE 1, VOYAGE 2 en NAVIGATE.
In september 2017 heeft het Comité voor geneesmiddelen voor menselijk gebruik (CHMP) van het Europees Geneesmiddelenbureau een positief advies uitgebracht waarin het een aanbeveling doet om in de Europese Unie een vergunning voor het in de handel brengen te verlenen voor het gebruik van guselkumab bij de behandeling van volwassenen met matige tot ernstige plaque psoriasis. het zijn kandidaten. voor systeemtherapie.
Guselkumab is momenteel niet beschikbaar in Nieuw-Zeeland (vanaf januari 2018).
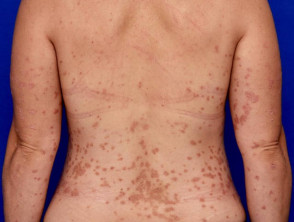
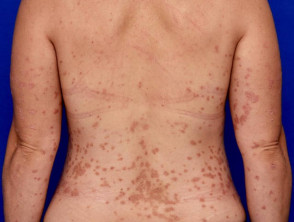
Matige tot ernstige psoriasis geschikt voor guselkumab
Matige psoriasis op de rug
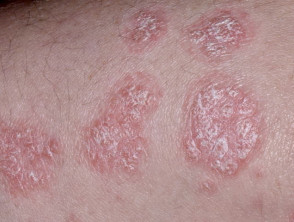
Chronische plaque psoriasis
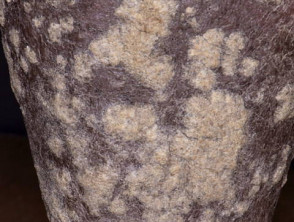
Psoriasis met zeer dikke schubben
TRIP 1 en 2 (vergeleken met guselkumab placebo of adalimumab)
- In totaal waren er 1443 patiënten gerandomiseerd naar guselkumab (100 mg in week 0 en 4 en daarna elke 8 weken), placebo of adalimumab (80 mg in week 0 en 40 mg in week 1, gevolgd door 40 mg om de week daarna).
- Patiënten hadden een Investigator Global Assessment (IGA)-score van ≥ 3 (matig) van de 5 punten. schaal van de algemene ernst van de ziekte, een ernstindex en het gebied van psoriasis (PASI) score ≥ 12 en een minimaal aangetast lichaamsoppervlak van 10%.
- Patiënten met guttata, erytrodermie of pustulair psoriasis was uitgesloten.
- De twee mede-primair eindpunten waren (1) het aantal personen dat een IGA-score van 0 (uitgesloten) of 1 (minimaal) behaalde; en (2) het aantal proefpersonen dat ten minste een 90%-reductie behaalde vanaf baseren op de samengestelde PASI-score (PASI 90).
- Zowel de VOYAGE 1- als de 2-studie evalueerden de respons in week 16 in vergelijking met placebo voor de twee co-primaire eindpunten.
- Effectiviteit De resultaten zijn samengevat in tabel 1.
Tabel 1. Werkzaamheidsresultaten in week 16 bij volwassenen met plaque psoriasis vergeleken met placebo in VOYAGE 1 en 2.
|
REIS 1 |
REIS 2 |
|||
|
belangrijkste eindpunt Aantal patiënten (%) |
Guselkumab (n=329) |
Placebo (n=174) |
Guselkumab (n=496) |
Placebo (n=248) |
|
IGA-respons van 0/1 |
280 (85) |
12 (7) |
417 (84) |
21 (8) |
|
Antwoord PASI 90 |
241 (73) |
5 (3) |
347 (70) |
6 (2) |
IGA, wereldwijde beoordelingsscore voor onderzoekers; PASI 90, 90% reductie ten opzichte van baseline in psoriasisgebied en samengestelde score op de ernstindex.
Vergelijking van guselkumab met adalimumab
Tabel 2 geeft de resultaten weer van een analyse van alle locaties in Noord-Amerika (VS en Canada) in de onderzoeken TRAVEL 1 en 2, waarmee de superioriteit van guselkumab ten opzichte van adalimumab wordt aangetoond.
Tabel 2. Werkzaamheidsresultaten van Guselkumab vs. Adalimumab bij plaquepsoriasis op locaties van VOYAGE 1 en 2 in Noord-Amerika
|
REIS 1 |
REIS 2 |
|||
|
Laatste punt Aantal patiënten (%) |
Guselkumab (n=115) |
Adalimumab (n=115) |
Guselkumab (n=160) |
Adalimumab (n=81) |
|
IgA-respons van 0 (helder) of 1 (minimaal) |
||||
|
week 16 |
97 (84) |
70 (61) |
119 (74) |
50 (62) |
|
week 24 |
97 (84) |
62 (54) |
119 (74) |
46 (57) |
|
week 48 |
91 (79) |
62 (54) |
NVT |
NVT |
|
IGA-antwoord van 0 (verwijderd) |
||||
|
week 24 |
61 (53) |
27 (23) |
76 (48) |
23 (28) |
|
week 48 |
54 (47) |
28 (24) |
NVT |
NVT |
|
Antwoord PASI 75 |
||||
|
week 16 |
105 (91) |
80 (70) |
132 (83) |
51 (63) |
|
Antwoord PASI 90 |
||||
|
week 16 |
84 (73) |
47 (44) |
102 (64) |
34 (42) |
|
week 24 |
92 (80) |
51 (41) |
113 (71) |
41 (51) |
|
week 48 |
84 (73) |
53 (46) |
NVT |
NVT |
reactie onderhoud
Om het behoud en de duurzaamheid van de respons in VOYAGE 2 te beoordelen, werden patiënten die in week 0 waren gerandomiseerd naar guselkumab en in week 28 PASI 90-responders waren, opnieuw gerandomiseerd naar guselkumab om de 8 weken of naar placebo. In week 48 behielden 89% van de patiënten die met guselkumab doorgingen PASI 90 in vergelijking met 37% die opnieuw werden gerandomiseerd naar placebo.
Door de patiënt gerapporteerde resultaten
Volgens de 16 weken durende Psoriasis Signs and Symptomen Diary (PSSD), vertoonden patiënten die met guselkumab werden behandeld grotere verbeteringen in jeuk, pijn, stekend gevoel, brandend gevoel en trekkerige huid in vergelijking met placebo, in de VOYAGE-onderzoeken 1 en 2. patiënten behandeld met guselkumab in vergelijking met adalimumab bereikten een PSSD symptoom score van 0 (geen symptomen) in week 24, in beide onderzoeken.
Bijwerkingen met guselkumab (TRIP 1 & 2)
Aangezien klinische proeven worden uitgevoerd onder zeer uiteenlopende omstandigheden, nadelige gebeurtenis Tarieven die in klinische onderzoeken zijn waargenomen, komen mogelijk niet overeen met de in de praktijk waargenomen percentages. Tabel 3 geeft een samenvatting van de bijwerkingen die vaak werden waargenomen in de VOYAGE 1- en 2-onderzoeken.
Tabel 3. Bijwerkingen die voorkwamen bij ≥ 1% patiënten tot en met week 16 in de onderzoeken Trip 1 en Trip 2
|
Bijwerkingen Aantal gebeurtenissen (% patiënten) |
Guselkumab (n=283) |
Adalimumab (n=196)
|
Placebo (n=422) Nr. (%) |
|
bovenste luchtwegen infecties |
118 (14,3) |
21 (10,7) |
54 (12,8) |
|
Hoofdpijn |
38 (4,6) |
2 (1) |
14 (3,3) |
|
Reacties op de injectieplaats |
37 (4,5) |
15 (7,7) |
12 (2,8) |
|
Artralgie |
22 (2,7) |
4 (2) |
9 (2,1) |
|
Diarree |
13 (1,6) |
3 (1,5) |
4 (0,9) |
|
Buikgriep |
11 (1,3) |
4 (2) |
4 (0,9) |
|
badkuip infectie |
9 (1,1) |
0 |
0 |
|
Herpes simplex infectie |
9 (1,1) |
0 |
2 (0,5) |
verhoogde lever enzymen
Verhoogde leverenzymen werden vaker gemeld in de guselkumab-groep (2.6%) dan in de placebogroep (1.9%). Van de 21 patiënten die verhoogde leverenzymen meldden in de guselkumab-groep, waren op één na alle voorvallen mild tot matig van ernst en geen van de voorvallen leidde tot stopzetting van het geneesmiddel.
Veiligheid tot week 48
De frequentie van bijwerkingen was vergelijkbaar met het waargenomen veiligheidsprofiel gedurende de eerste 16 weken van de behandeling.
NAVIGATE-studie (guselkumab vergeleken met ustekinumab)
- In deze Fase III, gerandomiseerd, dubbelblind studie, 871 patiënten ontvangen open ustekinumab (45 mg of 90 mg) in week 0 en 4.
- In week 16 werden 268 patiënten met een ontoereikende respons op ustekinumab (GAI ≥ 2) gerandomiseerd (dubbelblind) naar guselkumab 100 mg of gingen door met ustekinumab. 585 van de 871 patiënten (67%) met een IGA-respons van 0 (geklaard) of 1 (minimaal) in week 16 gingen door met open-label ustekinumab.
- Het primaire eindpunt was het aantal bezoeken waarbij gerandomiseerde patiënten IGA 0/1 bereikten en ten minste een verbetering van twee graden van week 28 tot week 40.
- Verbetering ≥ 90% of 100% op PASI (PASI 90/100) en Dermatologie Kwaliteit van leven-index (DLQI) scoren 0 of 1 werden ook geëvalueerd.
- de voor de helft Het aantal bezoeken waarbij patiënten een IGA-respons van 0 of 1 bereikten en een verbetering van ten minste 2 graden gedurende week 28 tot 40 was significant hoger in de guselkumab-groep dan in de gerandomiseerde ustekinumab-groep (1,5 versus 0,7;p <0,001).
- Een groter deel van de patiënten in de guselkumab-groep bereikte in vergelijking met de ustekinumab-groep een IGA-respons van 0 of 1 en een verbetering van ten minste 2 graden in week 28 en week 52.
- Een groter deel van de patiënten behandeld met guselkumab bereikte in vergelijking met ustekinumab PASI 90, PASI 100 en een DLQI-score van 0 of 1 in week 52.
- Na week 16 hadden 64,4% van de patiënten in de guselkumab-groep en 55,6% van de ustekinumab-groep ten minste één bijwerking; infecties waren het meest voorkomende type AE.
- In totaal had 6,7% (n=9) van de patiënten in de guselkumab-groep ten minste één ernstige bijwerking vergeleken met 4,5% (n=6) in de ustekinumab-groep.
- Tabellen 4 en 5 zijn een samenvatting van de belangrijkste resultaten en bijwerkingen van de NAVIGATE-studie.
Tabel 4. Werkzaamheidsresultaten van guselkumab vs. ustekinumab in NAVIGATE
|
werkzaamheidsparameter |
Guselkumab (n=135) |
Ustekinumab (n=133) |
p-waarde |
|
Mediaan aantal bezoeken waarbij patiënten een IGA-respons van 0 of 1 bereikten en een verbetering van ten minste twee graden (ten opzichte van week 16) van week 28 tot week 40 |
1,5 |
0,7 |
P≤0,001 |
|
Mediaan aantal bezoeken waarbij patiënten een IGA-respons van 0 bereikten van week 28 tot week 40 |
0,9 |
0.4 |
P≤0,001 |
|
Mediaan aantal bezoeken waarbij patiënten PASI 90 bereikten van week 28 tot week 40 |
2.2 |
1.1 |
P ≤0,001 |
|
Aantal patiënten met een IGA-respons van 0 of 1 en ≥ 2 graden verbetering (ten opzichte van week 16) in week 28 |
42 |
19 |
P ≤0,001 |
|
Aantal patiënten met een PASI 90-respons in week 28 |
Vijfenzestig |
30 |
P ≤0,001 |
|
Aantal patiënten met DLQI-score > 1 in week 16, |
103 |
105 |
P = 0,002 |
|
Aantal patiënten met een DLQI-score van 0 of 1 in week 52 |
40 |
20 |
|
|
Aantal patiënten met een PSSD-score > 0 in week 16 |
123 |
126 |
|
|
Aantal patiënten met een PSSD-score van 0 in week 52 |
25 |
12 |
P <0.05 |
DLQI, levenskwaliteitsindex voor dermatologie; Onderzoeker globale beoordelingsscore; PASI 90, 90% reductie ten opzichte van baseline in psoriasisgebied en samengestelde score voor ernstindex; PSSD, symptomen en tekenen van psoriasis dagelijks.
Tabel 5. Bijwerkingen gedurende week 1 tot 60 bij patiënten gerandomiseerd naar guselkumab of ustekinumab in NAVIGATE.
|
Nadelige gebeurtenis Aantal gebeurtenissen (% patiënten) |
Guselkumab (n=135) |
Ustekinumab (n=133) |
|
infecties |
57 (41,5%) |
47 (35,3%) |
|
Nasofaryngitis |
23 (17%) |
23 (17,3%) |
|
luchtweginfecties |
15 (11,1%) |
11 (8,3%) |
|
Reactie op de injectieplaats |
7 (1,1%) |
0 |
|
cardiovasculaire gebeurtenis |
2 (1,5%) |
1 (0,8%) |
|
maligniteit |
2 (1,5%) |
0 |
Guselkumab: toekomstig potentieel
- Guselkumab heeft bemoedigende gegevens gegenereerd over de werkzaamheid en veiligheid bij de behandeling van matige tot ernstige. chronisch plaque psoriasis.
- Resultaten van klinische fase III-onderzoeken suggereren dat guselkumab dat wel is hoger naar placebo in week 16 en is beter in staat om psoriasis te genezen of bijna te genezen platen in vergelijking met adalimumab. De effecten hielden aan tot week 48.
- Fase III-onderzoeken naar guselkumab rapporteren enkele van de hoogste PASI 90-percentages (in week 16, 73,3% in TRIP 1 en 70,0% in TRIP 2) tot nu toe. Het potentieel voor guselkumab om een PASI 90-respons te bereiken bij ≥70% patiënten suggereert dat guselkumab een significant positief effect kan hebben op de kwaliteit van leven van de patiënt.
- Uit de resultaten van de NAVIGATE-studie bleek dat guselkumab substantiële werkzaamheid had bij volwassenen met matige tot ernstige psoriasis en effectiever was dan ustekinumab bij patiënten met een ontoereikende respons op ustekinumab.
- Mogelijke redenen voor de superieure werkzaamheid van guselkumab in vergelijking met ustekinumab zijn de centrale rol van IL-23 in de pathogenese van psoriasis, een krachtigere blokkade van IL-23 met guselkumab, hogere en frequentere doses guselkumab en/of verbeterde Th17-responsen in de setting van remming van IL-12.
- Het gunstige bijwerkingenprofiel van guselkumab waargenomen in fase III-onderzoeken suggereert dat IL-23 mogelijk een meer psoriasisspecifiek cytokine is in vergelijking met andere cytokinen Wat tumor necrose factor-alfa en IL-17.
- Over het algemeen kan het richten op IL-23, een sleutelcytokine dat verschillende andere effectorcytokines aanstuurt, verantwoordelijk zijn voor de hoge werkzaamheid en duurzame reacties die worden gezien met guselkumab tot en met week 48.
- Er zijn meer langetermijnstudies nodig om de werkzaamheid en veiligheid van guselkumab op de lange termijn te begrijpen.