Introducción
En julio de 2017, la Administración de Drogas y Alimentos de los EE. UU. (FDA) aprobó guselkumab (Tremfya ™; Janssen Biotech, PA, EE. UU.) Para el tratamiento de adultos con síntomas de moderado a grave placa psoriasis que son candidatos a sistémico terapia o fototerapia. Guselkumab es la terapia biológica primer y único aprobado que sólo bloquea selectivamente interleucina (IL) -23, a citocina que juega un papel clave en la psoriasis en placas.
Guselkumab recibió la aprobación de la FDA según los resultados de un estudio clínico. desarrollo programa que incluyó a más de 2,000 pacientes en los estudios Fase III VOYAGE 1, VOYAGE 2 y NAVIGATE.
En septiembre de 2017, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos adoptó un dictamen positivo recomendando la autorización de comercialización en la Unión Europea para el uso de guselkumab en el tratamiento de adultos con psoriasis en placas de moderada a grave que son candidatos. para terapia sistémica.
Guselkumab actualmente no está disponible en Nueva Zelanda (en enero de 2018).
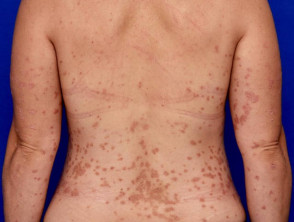
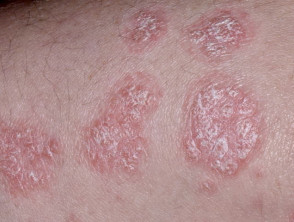
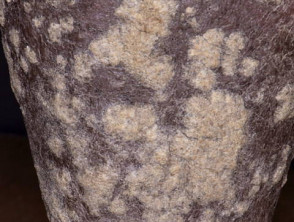
Psoriasis de moderada a grave adecuada para guselkumab
Psoriasis moderada en la espalda
Psoriasis crónica en placas
Psoriasis con escamas muy gruesas
VIAJE 1 y 2 (en comparación con el guselkumab placebo o adalimumab)
- Un total de 1443 pacientes fueron aleatorizado a guselkumab (100 mg en las semanas 0 y 4 y cada 8 semanas a partir de entonces), placebo o adalimumab (80 mg en la semana 0 y 40 mg en la semana 1, seguidos de 40 mg en semanas alternas a partir de entonces).
- Los pacientes tenían una puntuación de la Evaluación Global del Investigador (IGA) de ≥ 3 (moderada) en una puntuación de 5 puntos. escala de la gravedad general de la enfermedad, un índice de gravedad y área de psoriasis (PASI) puntuación ≥ 12 y una superficie corporal mínima afectada del 10%.
- Los pacientes con psoriasis guttata, eritrodérmica, o pustuloso se excluyó la psoriasis.
- Los dos co-primario los criterios de valoración fueron (1) la proporción de individuos que alcanzaron una puntuación IGA de 0 (eliminada) o 1 (mínima); y (2) la proporción de sujetos que alcanzó al menos una reducción del 90% a partir de base en la puntuación compuesta PASI (PASI 90).
- Tanto los ensayos VOYAGE 1 como 2 evaluaron las respuestas en la semana 16 en comparación con placebo para los dos criterios de valoración coprimarios.
- Eficacia Los resultados se resumen en la Tabla 1.
Tabla 1. Resultados de eficacia en la semana 16 en adultos con psoriasis en placas en comparación con placebo en VOYAGE 1 y 2.
|
VIAJE 1 |
VIAJE 2 |
|||
|
Variable principal No. de pacientes (%) |
Guselkumab (n = 329) |
Placebo (n = 174) |
Guselkumab (n = 496) |
Placebo (n = 248) |
|
Respuesta IGA de 0/1 |
280 (85) |
12 (7) |
417 (84) |
21 (8) |
|
Respuesta PASI 90 |
241 (73) |
5 (3) |
347 (70) |
6 (2) |
IGA, puntaje de evaluación global del investigador; PASI 90, reducción del 90% con respecto al valor inicial en la puntuación compuesta del índice de gravedad y área de psoriasis.
Comparación de guselkumab con adalimumab
La Tabla 2 presenta los resultados de un análisis de todos los sitios de América del Norte (EE.UU. y Canadá) en los ensayos VIAJE 1 y 2, lo que demuestra la superioridad de guselkumab a adalimumab.
Tabla 2. Resultados de eficacia de guselkumab frente a adalimumab en la psoriasis en placas en los sitios de VOYAGE 1 y 2 de América del Norte
|
VIAJE 1 |
VIAJE 2 |
|||
|
Punto final No. de pacientes (%) |
Guselkumab (n = 115) |
Adalimumab (n = 115) |
Guselkumab (n = 160) |
Adalimumab (n = 81) |
|
respuesta de IgA de 0 (aclarado) o 1 (mínimo) |
||||
|
Semana 16 |
97 (84) |
70 (61) |
119 (74) |
50 (62) |
|
Semana 24 |
97 (84) |
62 (54) |
119 (74) |
46 (57) |
|
Semana 48 |
91 (79) |
62 (54) |
N / A |
N / A |
|
Respuesta IGA de 0 (borrado) |
||||
|
Semana 24 |
61 (53) |
27 (23) |
76 (48) |
23 (28) |
|
Semana 48 |
54 (47) |
28 (24) |
N / A |
N / A |
|
Respuesta PASI 75 |
||||
|
Semana 16 |
105 (91) |
80 (70) |
132 (83) |
51 (63) |
|
Respuesta PASI 90 |
||||
|
Semana 16 |
84 (73) |
47 (44) |
102 (64) |
34 (42) |
|
Semana 24 |
92 (80) |
51 (41) |
113 (71) |
41 (51) |
|
Semana 48 |
84 (73) |
53 (46) |
N / A |
N / A |
Mantenimiento de respuesta
Para evaluar el mantenimiento y la durabilidad de la respuesta en VOYAGE 2, los pacientes asignados al azar a guselkumab en la semana 0 que respondieron al PASI 90 en la semana 28 fueron reasignados al azar a guselkumab cada 8 semanas o placebo. En la semana 48, el 89% de los pacientes que continuaron el tratamiento con guselkumab mantuvieron PASI 90 en comparación con el 37% que fueron reasignados al azar a placebo.
Resultados informados por el paciente
Según el Diario de signos y síntomas de la psoriasis (PSSD) de la semana 16, los pacientes tratados con guselkumab mostraron mayores mejoras en la picazón, dolor, escozor, ardor y tirantez de la piel en comparación con el placebo, en los ensayos VOYAGE 1 y 2. Una mayor proporción de pacientes tratados con guselkumab en comparación con adalimumab lograron una PSSD síntoma puntuación de 0 (sin síntomas) en la semana 24, en ambos ensayos.
Eventos adversos con guselkumab (VIAJE 1 y 2)
Dado que los ensayos clínicos se llevan a cabo en condiciones muy diversas, acontecimiento adverso Las tasas observadas en los ensayos clínicos pueden no reflejar las tasas observadas en la práctica. La Tabla 3 resume los eventos adversos comúnmente observados en los ensayos VOYAGE 1 y 2.
Tabla 3. Eventos adversos que ocurrieron en ≥ 1% de los pacientes hasta la Semana 16 en los ensayos del Viaje 1 y del Viaje 2
|
Eventos adversos No. de eventos (% de pacientes) |
Guselkumab (n = 283) |
Adalimumab (n = 196)
|
Placebo (n = 422) No. (%) |
|
Respiratorio superior infecciones |
118 (14,3) |
21 (10,7) |
54 (12,8) |
|
Dolor de cabeza |
38 (4,6) |
2 (1) |
14 (3,3) |
|
Reacciones en el lugar de la inyección |
37 (4,5) |
15 (7,7) |
12 (2,8) |
|
Artralgia |
22 (2,7) |
4 (2) |
9 (2,1) |
|
Diarrea |
13 (1,6) |
3 (1,5) |
4 (0,9) |
|
Gastroenteritis |
11 (1,3) |
4 (2) |
4 (0,9) |
|
Tiña infección |
9 (1,1) |
0 |
0 |
|
Herpes simplex infección |
9 (1,1) |
0 |
2 (0,5) |
Hígado elevado enzimas
Las enzimas hepáticas elevadas se notificaron con mayor frecuencia en el grupo de guselkumab (2,6%) que en el grupo de placebo (1,9%). De los 21 pacientes que informaron de enzimas hepáticas elevadas en el grupo guselkumab, todos los eventos excepto uno fueron leves a moderados en gravedad y ninguno de los eventos dirigidos a la suspensión del fármaco.
Seguridad hasta la semana 48
La frecuencia de EA fue similar al perfil de seguridad observado durante las primeras 16 semanas de tratamiento.
Ensayo NAVIGATE (guselkumab en comparación con ustekinumab)
- En esta Fase III, aleatorizados, doble ciego estudio, 871 pacientes recibieron abierto ustekinumab (45 mg o 90 mg) en las Semanas 0 y 4.
- En la semana 16, 268 pacientes con una respuesta inadecuada a ustekinumab IGA ≥ 2) fueron aleatorizados (doble ciego) para guselkumab 100 mg o continuar ustekinumab. 585 de 871 pacientes (67%) con respuesta IGA de 0 (aclarado) o 1 (mínimo) en la semana 16 continuaron con ustekinumab abierto.
- El criterio de valoración principal fue el número de visitas en las que los pacientes asignados al azar lograron IGA 0/1 y al menos una mejora de dos grados desde la semana 28 hasta la semana 40.
- Mejoría ≥ 90% o 100% en PASI (PASI 90/100) y Dermatología Índice de calidad de vida (DLQI) de puntuación de O o 1 también se evaluaron.
- los media El número de visitas en las que los pacientes lograron una respuesta IGA de 0 o 1 y al menos una mejora de dos grados durante las semanas 28 a 40 fue significativamente mayor en el grupo de guselkumab frente al grupo de ustekinumab aleatorizado (1,5 frente a 0,7; p <0,001).
- Una mayor proporción de pacientes en el grupo de guselkumab en comparación con el grupo de ustekinumab logró una respuesta IGA de 0 o 1 y al menos una mejoría de dos grados en la semana 28 y la semana 52.
- Una mayor proporción de pacientes tratados con guselkumab en comparación con ustekinumab alcanzó PASI 90, PASI 100 y una puntuación DLQI de 0 o 1 en la semana 52.
- Después de la semana 16, el 64,4% de los pacientes del grupo guselkumab y el 55,6% del grupo ustekinumab presentaron al menos un EA; las infecciones fueron el tipo de EA más frecuente.
- En general, el 6,7% (n = 9) de los pacientes del grupo de guselkumab tuvo al menos un EA grave en comparación con el 4,5% (n = 6) del grupo de ustekinumab.
- Las Tablas 4 y 5 son un resumen de los resultados clave y EA del ensayo NAVIGATE.
Tabla 4. Resultados de eficacia de guselkumab frente a ustekinumab en NAVIGATE
|
Parámetro de eficacia |
Guselkumab (n = 135) |
Ustekinumab (n = 133) |
Valor p |
|
Número medio de visitas en las que los pacientes lograron una respuesta IGA de 0 o 1 y al menos una mejora de dos grados (en relación con la semana 16) desde la semana 28 hasta la semana 40 |
1,5 |
0,7 |
pag≤ 0,001 |
|
Número medio de visitas en las que los pacientes lograron una respuesta IGA de 0 desde la semana 28 hasta la semana 40 |
0,9 |
0.4 |
pag≤ 0,001 |
|
Número medio de visitas en las que los pacientes alcanzaron un PASI 90 desde la semana 28 hasta la semana 40 |
2.2 |
1.1 |
pag ≤ 0,001 |
|
Número de pacientes con una respuesta IGA de 0 o 1 y mejoría ≥ 2 grados (en relación con la semana 16) en la semana 28 |
42 |
19 |
pag ≤ 0,001 |
|
Número de pacientes con una respuesta PASI 90 en la semana 28 |
sesenta y cinco |
30 |
pag ≤ 0,001 |
|
Número de pacientes con puntuación DLQI> 1 en la semana 16, |
103 |
105 |
pag = 0,002 |
|
Número de pacientes con puntuación DLQI de 0 o 1 en la semana 52 |
40 |
20 |
|
|
Número de pacientes con una puntuación PSSD> 0 en la semana 16 |
123 |
126 |
|
|
Número de pacientes con una puntuación PSSD de 0 en la semana 52 |
25 |
12 |
pag <0.05 |
DLQI, índice de calidad de vida en dermatología; Puntuación de la evaluación global del investigador; PASI 90, reducción del 90% desde el valor inicial en la puntuación compuesta del índice de gravedad y área de psoriasis; PSSD, síntomas de la psoriasis y de los signos diario.
Tabla 5. Eventos adversos durante las semanas 1 a 60 en pacientes aleatorizados a guselkumab o ustekinumab en NAVIGATE
|
Acontecimiento adverso No. de eventos (% de pacientes) |
Guselkumab (n = 135) |
Ustekinumab (n = 133) |
|
Infecciones |
57 (41,5%) |
47 (35,3%) |
|
Nasofaringitis |
23 (17%) |
23 (17,3%) |
|
Infecciones del tracto respiratorio |
15 (11,1%) |
11 (8,3%) |
|
Reacción en el lugar de la inyección |
7 (1,1%) |
0 |
|
Evento cardiovascular |
2 (1,5%) |
1 (0,8%) |
|
Malignidad |
2 (1,5%) |
0 |
Guselkumab: potencial futuro
- Guselkumab ha generado datos alentadores sobre la eficacia y seguridad en el tratamiento de moderados a graves. crónico soriasis en placas.
- Los resultados de los ensayos clínicos de fase III sugieren que es guselkumab superior al placebo en la semana 16 y es más capaz de eliminar o casi eliminar la psoriasis placas en comparación con adalimumab. Los efectos se mantuvieron hasta la semana 48.
- estudios de fase III de guselkumab reportan algunos de los más altos PASI 90 tasas (en la semana 16, el 73,3% en VIAJE 1 y 70,0% en VIAJE 2) hasta la fecha. El potencial de guselkumab para lograr una respuesta PASI 90 en ≥ 70% de los pacientes sugiere que guselkumab puede tener un impacto positivo significativo en la calidad de vida del paciente.
- Los resultados del ensayo NAVIGATE establecieron que guselkumab tuvo una eficacia sustancial en adultos con psoriasis de moderada a grave y fue más eficaz que ustekinumab en pacientes con una respuesta inadecuada a ustekinumab.
- Las posibles razones de la eficacia superior de guselkumab en comparación con ustekinumab incluyen el papel central de IL-23 en la Patogénesis de psoriasis, un bloqueo más potente de IL-23 con guselkumab, dosis más altas y más frecuentes de guselkumab, y / o respuestas Th17 mejoradas en el contexto de la inhibición de IL-12.
- El perfil favorable de EA de guselkumab observado en los estudios de fase III sugiere que la IL-23 puede ser una citocina más específica de psoriasis en comparación con otras citocinas como tumor necrosis factor-alfa e IL-17.
- En general, la orientación IL-23, una citoquina clave que impulsa diversas otras citocinas efectoras, puede ser responsable de la alta eficacia y respuestas duraderas observados con guselkumab hasta la Semana 48.
- Se necesitan más estudios a largo plazo para comprender la eficacia y seguridad a largo plazo de guselkumab.