Was sind Sie Chromosomen?
Die Chromosomen tragen genetisch Material von a Organismus (Desoxyribonukleinsäure [DNS]). In menschlichen Zellen gibt es 23 Chromosomenpaare. Diese Chromosomen enthalten alle genetischen Informationen, die jede Zelle im Körper benötigt, um richtig zu funktionieren.
Anomalien in Chromosomen kann eine Vielzahl von genetischen Störungen verursachen, die zu führen können Entwicklung verzögern, angeboren Defekte und abnorme Körperfunktionen [1].
Diese genetischen Erkrankungen können auf den Verlust oder Gewinn von Chromosomen oder auf Deletionen oder Duplikationen eines Chromosoms zurückzuführen sein Chromosom. In diesen Fällen fehlt eine bestimmte Zelle Gene und deshalb kann ich mir nicht sicher sein Protein und seine Funktion korrekt erfüllen. Beispiele relevant für Dermatologie einschließen:
- Nieder Syndrom (Trisomie 21, bei der es drei Kopien von Chromosom 21 gibt)
- Turner-Syndrom (ein einziges funktionsfähiges X-Chromosom)
- DiGeorge-Syndrom (Deletion von Genen auf Chromosom 22).
Was ist es zytogenetisch Prüfungen?
Zytogenetik ist das Studium der Chromosomen und ihrer Struktur [2].
Zytogenetische Tests umfassen die Analyse von Zellen in einer Blut-, Gewebe-, Fruchtwasser Flüssigkeit, Knochenmark oder zerebrovaskulär Flüssigkeit, um Veränderungen in den Chromosomen einer Person zu identifizieren.
Es gibt drei Hauptmethoden für zytogenetische Tests:
- routinemäßiger Karyotyp
- Fluoreszierend an dem Ort HybridisierungFISCH)
- Vergleichende genomische Hybridisierung (CGH) und Ausbildung vergleichende genomische Hybridisierung (aCGH).
Karyotyp
Der Karyotyp war eine der ersten Methoden der Chromosomenanalyse. Diese Methode verwendet Licht Mikroskopie und standardisierte Färbeverfahren an Zellen in der Metaphase des Zellzyklus, wenn die Chromosomen vor der Trennung entlang des Zelläquators ausgerichtet und stärker verdichtet sind [3].
das ... zu machen chromosomal Für eine effektivere und effizientere Analyse wurden Farbstoffe entwickelt, die an DNA binden und charakteristische Bandenmuster erzeugen, um verschiedene Chromosomen zu identifizieren [3]. Die am weitesten verbreitete Färbung ist die Giemsa-Färbung [3]. Durch diesen Prozess können die Chromosomen in einem Karyogramm mit 23 Paaren und beliebig angeordnet werden Anomalie einschließlich Aneuploidie (eine abnormale Anzahl von Chromosomen) und groß Translokationen (wo Teile der Chromosomen ineinander verpflanzt werden) identifiziert werden können.
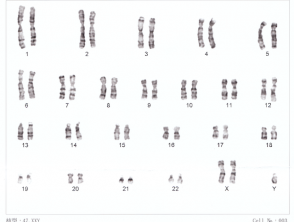
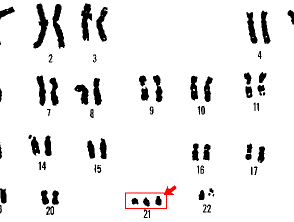
Karyotypisierung kann nur Veränderungen mit einer Größe von etwa 3 Megabasen identifizieren [3]. Jede Anomalie, die weniger als diesen Wert umfasst, wird durch die routinemäßige Karyotypisierung nicht erkannt. Karyotypisierung kann verwendet werden, um das Down-Syndrom und das Turner-Syndrom zu identifizieren.
Karyotyp für Down-Syndrom
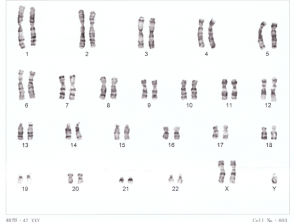
Menschliche XXY-Chromosomen
21 Trisomie Down-Syndrom
Fluoreszenz-in-situ-Hybridisierung
FISH wurde erstmals Ende der 1980er Jahre eingeführt und hat sich schnell zu einem bekannten diagnostischen zytogenetischen Test bei angeborenen und erworbenen Krankheiten entwickelt. [4]. FISH hat eine viel höhere Auflösung als die routinemäßige Karyotypisierung [3], insbesondere wenn es an Zellen in der Interphase verwendet wird (Phasenzellen bleiben in, wenn sie nicht in Phase sind). Mitose) [5].
FISH verwendet fluoreszierende Sonden mit komplementären Basensequenzen, um das Vorhandensein oder Fehlen spezifischer DNA-Abschnitte auf Chromosomen zu lokalisieren [2,6]. Die Sonde und die Ziel-DNA müssen mit Hitze oder Chemikalien denaturiert werden, um die Wasserstoffbindungen in der DNA aufzubrechen und eine Hybridisierung zu ermöglichen, sobald die beiden Proben gemischt sind. [5]. Die fluoreszierenden Sonden bilden mit ihren komplementären Basenpaaren in der DNA neue Wasserstoffbrückenbindungen, die dann mikroskopisch nachgewiesen werden können. [5].
FISH wird üblicherweise verwendet, um spezifische chromosomale Deletionen oder damit verbundene Translokationen zu erkennen pädiatrisch Krankheiten oder Krebs [2]. Beispiele hierfür sind die Deletion auf Chromosom 22 beim DiGeorge-Syndrom und die Translokation von einem Gen auf den Chromosomen 22 und 9 Zoll chronisch myeloisch Leukämie [2].
FISCH ist auch daran gewöhnt melanozytisch Verletzungen unterscheiden atypisch melanozytisch nevi (zB Spitz Nävus) von Melanom.
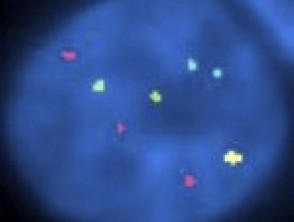
Fluoreszenz-in-situ-Hybridisierung beim Melanom im Kindesalter
FISH-Pathologie des Melanoms im Kindesalter
Vergleichende genomische Hybridisierung
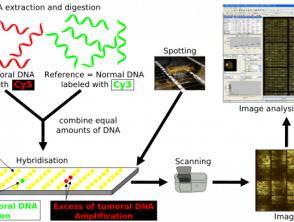
CGH ist eine Methode der molekular zytogenetische Tests zum Nachweis chromosomaler Kopienzahlvarianten (Teile der Genom bei Verdopplung oder Verdreifachung von Genabschnitten) ohne die Notwendigkeit einer Zellkultur [7]. Es wurde zuerst entwickelt, um solche Veränderungen in Tumoren zu identifizieren. [7,8].
CGH verwendet 2 Genome; die Testprobe u Steuerung, die beide fluoreszenzmarkiert sind, um zwischen den beiden zu unterscheiden [8]. Die beiden Proben werden denaturiert und gemischt, wodurch eine Hybridisierung der Metaphase-Chromosomen ermöglicht wird. Die Intensität des Fluoreszenzsignals der markierten Test-DNA relativ zur Kontroll-DNA kann entlang jedes Chromosoms aufgetragen werden, was den Verlust oder Gewinn an genetischem Material zeigt und die Identifizierung beliebiger Varianten der Kopienzahl ermöglicht. [8].
CGH unterscheidet sich von anderen zytogenetischen Testverfahren dadurch, dass es weder auf ein bestimmtes Target angewiesen ist noch Vorkenntnisse über die zu untersuchende Region erfordert. [8]. Stattdessen kann CGH ein gesamtes Genom schnell auf chromosomale Ungleichgewichte scannen und ist in Fällen nützlich, in denen die Diagnose unbekannt ist. [8]. Eine Einschränkung von CGH ist die Größe der genetischen Veränderung, die es identifizieren kann; Die CGH-Auflösung ist mit etwa 5-10 Megabasen schlecht [8].
Vergleichende genomische Hybridisierung
Array Comparative Genomic Hybridization Protocol
Vergleichendes genomisches Hybridisierungs-Array
aCGH verwendet eine ähnliche Technik wie CGH, bietet jedoch durch die Verwendung eine viel höhere Auflösung Microarray [8]. Kleine DNA-Abschnitte werden als Targets für die Analyse verwendet; diese Abschnitte sind immobilisiert solide Unterstützung, die die DNA an einem Punkt verankert, ohne die zu verändern Protein [8]. Wie bei CGH werden Proben- und Kontroll-DNA fluoreszenzmarkiert, um zwischen ihnen zu unterscheiden.
Die Proben werden dann gemischt und der hinzugefügt Microarray wo sie um die Bindung an die Sonden auf dem Microarray konkurrieren [8]. Die Stärke der verschiedenen Fluoreszenzsignale kann bewertet und kleine Gewinne oder Verluste innerhalb der DNA identifiziert werden. Ein Nachteil von aCGH ist, dass es keine balancierten chromosomalen Strukturveränderungen wie balancierte Translokationen oder Inversionen erkennen kann. [zwei].
Wann sind zytogenetische Tests indiziert?
Zytogenetische Tests werden verwendet, wenn eine genetische Anomalie vermutet wird.
Vorgeburtlich Tests in einer Risikoschwangerschaft
Zytogenetische Tests werden während der Schwangerschaft an gewonnenen Proben durchgeführt. im Mutterleib über Amniozentese oder von Probenahme von Chorionzotten um einen Fötus mit chromosomalen Anomalien wie Trisomie 21 beim Down-Syndrom zu identifizieren.
Diagnosetest
Zytogenetische Tests werden häufig in verwendet Pädiatrie in einem Versuch, die zugrunde liegende Ursache von Entwicklungsstörungen oder Geburtsfehlern zu identifizieren. Eine Diagnose kann für die Familien betroffener Kinder eine große Erleichterung sein und ermöglicht Ratschläge zur angemessenen Behandlung und Behandlung Prognose.
Hämatologisch Krebs
Zytogenetische Tests werden bei hämatologischen Krebserkrankungen wie chronischer myeloischer Leukämie eingesetzt, bei denen eine spezifische reziproke Translokation zwischen den Chromosomen 22 und 9 zum Philadelphia-Chromosom führt, das in 95%-Fällen vorhanden ist.
Welches sind die Kontraindikationen mit zytogenetischen Tests?
Es gibt keine medizinischen Kontraindikationen für zytogenetische Tests. Eine informierte Zustimmung muss eingeholt werden, bevor der Test arrangiert wird.
Was sind die Vorteile von zytogenetischen Tests?
Zytogenetische Tests können Diagnosen bieten und bei der langfristigen Behandlung relevanter Krankheiten helfen. Es ermöglicht auch eine genetische Beratung für die Patientin oder ihre Eltern über das damit verbundene Risiko in zukünftigen Schwangerschaften und leitet den Genetiker in einigen Fällen an, ob es ratsam ist, andere Familienmitglieder zu testen.
Welche Nachteile haben zytogenetische Tests?
Leider sind zytogenetische Tests durch ihre Auflösung begrenzt. Verschiedene Methoden können kleine Gewinne und Verluste an genetischem Material sowie größere Translokationen identifizieren, erlauben jedoch keine Prüfung auf eine einzelne Translokation. Nukleotid Variationen, die zum Zustand des Patienten beitragen könnten. Es besteht auch die Möglichkeit, dass zytogenetische Tests andere Chromosomenveränderungen identifizieren, die nicht unbedingt mit dem Zustand des Patienten zusammenhängen.