Quali sono cromosomi?
I cromosomi portano il genetico materiale di a organismo (acido desossiribonucleico [DNA]). Ci sono 23 coppie di cromosomi nelle cellule umane. Questi cromosomi contengono tutte le informazioni genetiche necessarie affinché ogni cellula del corpo funzioni correttamente.
Anomalie nei cromosomi può causare una varietà di malattie genetiche che possono portare a evolutivo ritardare, congenita difetti e funzione corporea anormale [1].
Queste malattie genetiche possono essere dovute alla perdita o all'aumento di cromosomi o quando ci sono delezioni o duplicazioni di a cromosoma. In questi casi manca una cella specifica geni e quindi non posso essere sicuro proteina ed eseguire correttamente la sua funzione. Esempi rilevanti per dermatologia includere:
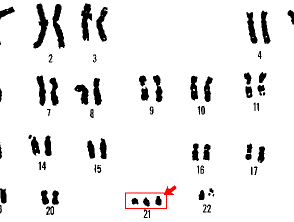
- Giù sindrome (trisomia 21, dove sono presenti tre copie del cromosoma 21)
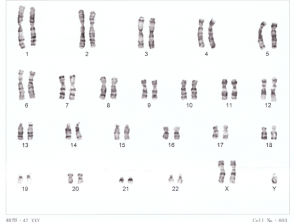
- Sindrome di Turner (un singolo cromosoma X funzionale)
- Sindrome di DiGeorge (delezione genica sul cromosoma 22).
Che cos'è citogenetico test?
Citogenetica è lo studio dei cromosomi e della loro struttura [2].
Il test citogenetico prevede l'analisi delle cellule in un campione di sangue, tessuto, amniotico fluido, midollo osseo o cerebrovascolare liquido per identificare eventuali cambiamenti nei cromosomi di un individuo.
Esistono tre metodi principali di test citogenetico:
- Cariotipo di routine
- Fluorescente nel posto ibridazionePESCE)
- Ibridazione genomica comparativa (CGH) e formazione Ibridazione genomica comparativa (aCGH).
Cariotipo
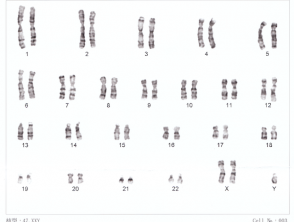
Il cariotipo è stato uno dei primi metodi di analisi cromosomica. Questo metodo utilizza la luce microscopia e procedure di colorazione standardizzate nelle cellule nella porzione metafase del ciclo cellulare, quando i cromosomi sono allineati lungo l'equatore della cellula prima della separazione e sono più condensati [3].
Per fare il cromosomica Analisi più efficaci ed efficienti, le macchie sono state sviluppate per legarsi con il DNA e produrre modelli caratteristici di bande per identificare diversi cromosomi [3]. Il colorante più utilizzato è il colorante Giemsa [3]. Attraverso questo processo, i cromosomi possono essere disposti in un cariogramma a 23 coppie e qualsiasi anomalia che coinvolge aneuploidia (un numero anormale di cromosomi) e di grandi dimensioni traslocazioni (dove le parti dei cromosomi vengono trapiantate l'una nell'altra) possono essere identificate.
Il cariotipo può identificare solo cambiamenti di dimensioni di circa 3 megabasi [3]. Qualsiasi anomalia che coinvolga meno di questo non verrà rilevata dal cariotipo di routine. Il cariotipo può essere utilizzato per identificare la sindrome di Down e la sindrome di Turner.
Cariotipo per la sindrome di Down
XXY cromosomi umani
21 trisomia sindrome di Down
Ibridazione in situ fluorescente
La FISH è stata introdotta per la prima volta alla fine degli anni '80 ed è diventata rapidamente un noto test citogenetico diagnostico nelle malattie congenite e acquisite. [4]. FISH ha una risoluzione molto più alta rispetto al cariotipo di routine [3], specialmente se utilizzato nelle cellule in interfase (le cellule in fase rimangono quando non sono in mitosi) [5].
FISH utilizza sonde fluorescenti con sequenze di basi complementari per localizzare la presenza o l'assenza di porzioni specifiche di DNA sui cromosomi [2,6]. La sonda e il DNA target devono essere denaturati con calore o sostanze chimiche per rompere i legami idrogeno nel DNA e consentire l'ibridazione una volta miscelati i due campioni. [5]. Le sonde fluorescenti formano nuovi legami idrogeno con le loro coppie di basi complementari nel DNA, che possono quindi essere rilevate al microscopio. [5].
La FISH è comunemente usata per rilevare delezioni cromosomiche specifiche o traslocazioni associate pediatrico condizioni o tumori [2]. Gli esempi includono la delezione sul cromosoma 22 nella sindrome di DiGeorge e il traslocazione da un gene sui cromosomi 22 e 9 pollici cronica mieloide leucemia [2].
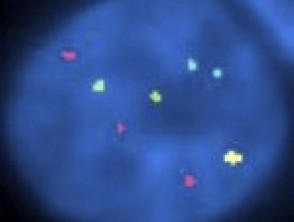
Anche FISH è abituato melanocitico lesioni distinguere atipico melanocitico nevi (ad esempio, Spitz nevo) da melanoma.
Ibridazione in situ fluorescente nel melanoma infantile
Patologia FISH del melanoma infantile
Ibridazione genomica comparativa
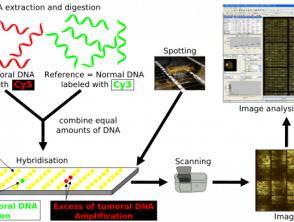
CGH è un metodo di molecolare Test citogenetici che rilevano le varianti del numero di copie cromosomiche (parti del file genoma dove le sezioni geniche sono raddoppiate o triplicate) senza la necessità di colture cellulari [7]. È stato inizialmente sviluppato per identificare tali cambiamenti nei tumori. [7.8].
CGH utilizza 2 genomi; il campione di prova e a controllo, che sono etichettati in modo fluorescente per differenziare tra i due [8]. I due campioni vengono denaturati e miscelati, consentendo l'ibridazione dei cromosomi in metafase. L'intensità del segnale fluorescente del DNA di prova marcato rispetto al DNA di controllo può essere tracciata lungo ciascun cromosoma, mostrando la perdita o il guadagno di materiale genetico e consentendo l'identificazione di qualsiasi variante del numero di copie. [8].
Il CGH si differenzia da altri metodi di analisi citogenetica in quanto non dipende da un obiettivo specifico, né richiede una conoscenza preliminare della regione in esame. [8]. Invece, CGH può scansionare rapidamente un intero genoma per squilibri cromosomici ed è utile nei casi in cui la diagnosi è sconosciuta. [8]. Una limitazione del CGH è la dimensione dell'alterazione genetica che può identificare; La risoluzione CGH è scarsa a circa 5-10 megabasi [8].
Ibridazione genomica comparativa
Matrix Comparative Genomic Hybridization Protocol
Matrice di ibridazione genomica comparativa
aCGH utilizza una tecnica simile a CGH ma fornisce una risoluzione molto più elevata durante l'utilizzo microarray [8]. Piccole sezioni di DNA vengono utilizzate come target per l'analisi; queste sezioni sono immobilizzate in solido supporto, che fissa il DNA a un punto senza alterare il proteina [8]. Come in CGH, il campione e il DNA di controllo sono etichettati in modo fluorescente per differenziarli.
I campioni vengono quindi miscelati e aggiunti al microarray dove competono per legarsi alle sonde sul microarray [8]. È possibile valutare la forza dei diversi segnali fluorescenti e identificare piccoli guadagni o perdite all'interno del DNA. Uno svantaggio di aCGH è che non è in grado di rilevare cambiamenti strutturali cromosomici bilanciati, come traslocazioni o inversioni bilanciate. [2].
Quando sono indicati i test citogenetici?
I test citogenetici vengono utilizzati quando si sospetta un'anomalia genetica.
Prenatale test in una gravidanza ad alto rischio
I test citogenetici vengono eseguiti durante la gravidanza sui campioni ottenuti. nel grembo materno attraverso amniocentesi o da campionamento dei villi coriali per identificare un feto con anomalie cromosomiche, come la trisomia 21 nella sindrome di Down.
Test diagnostici
Il test citogenetico viene spesso utilizzato in pediatria nel tentativo di identificare la causa sottostante di disturbi dello sviluppo o difetti alla nascita. Una diagnosi può essere di grande sollievo per le famiglie dei bambini affetti e consentirà una consulenza sulla corretta gestione e previsione.
Ematologico Cancro
Il test citogenetico viene utilizzato nei tumori ematologici come la leucemia mieloide cronica, dove una specifica traslocazione reciproca tra i cromosomi 22 e 9 determina il cromosoma Philadelphia, che è presente nel 95% dei casi.
Quali sono i file controindicazioni con test citogenetici?
Non ci sono controindicazioni mediche per i test citogenetici. È necessario ottenere il consenso informato prima di organizzare i test.
Quali sono i vantaggi dei test citogenetici?
I test citogenetici possono offrire diagnosi e aiutare nella gestione a lungo termine delle malattie rilevanti. Consente inoltre la consulenza genetica per la paziente oi suoi genitori sul rischio correlato a future gravidanze e, in alcuni casi, guida il genetista sull'opportunità di testare altri membri della famiglia.
Quali sono gli svantaggi dei test citogenetici?
Sfortunatamente, i test citogenetici hanno una risoluzione limitata. I diversi metodi possono identificare piccoli guadagni e perdite di materiale genetico, nonché traslocazioni più grandi, ma non consentono di testare un singolo nucleotide variazioni che potrebbero contribuire alle condizioni del paziente. C'è anche la possibilità che i test citogenetici identificheranno altri cambiamenti cromosomici che non sono necessariamente correlati alle condizioni del paziente.