Was ist Cemiplimab?
Cemiplimab (auch Cemiplimab-rwlc genannt; Markenname Libtayo®) ist ein verschreibungspflichtiges Medikament zur Behandlung von Menschen mit Haut- schuppig Zelle Karzinom (SCC).
Im April 2018 hat die Europäische Arzneimittel-Agentur (EMA) den Zulassungsantrag für Cemiplimab zur Behandlung von Patienten zur Prüfung angenommen metastatisch Kutanes SCC oder lokal fortgeschrittenes kutanes SCC, die nicht für eine Operation in Frage kommen.
Im September 2018 hat die US-amerikanische Food and Drug Administration (FDA) Cemiplimab als innovative Therapie zur Behandlung von Patienten mit metastasiertem kutanem SCC oder lokal fortgeschrittenem SCC zugelassen, die nicht für eine kurative Operation oder kurative Bestrahlung in Frage kommen. Regeneron und Sanofi-Aventis (New Jersey, USA) werden Libtayo vermarkten® gemeinsam in den USA
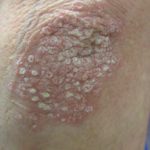
Lokal fortgeschrittenes Plattenepithelkarzinom der Haut
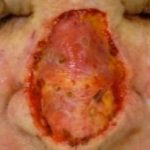
Fortgeschrittenes Plattenepithelkarzinom, das in einer thermischen Brandnarbe entsteht
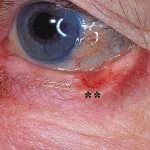
fortgeschrittenes Plattenepithelkarzinom
fortgeschrittenes Plattenepithelkarzinom
Cemiplimab ist die erste und einzige Behandlung, die speziell für fortgeschrittenes kutanes SCC in den USA zugelassen und verfügbar ist.Dieses Medikament wurde von der FDA im Rahmen einer vorrangigen Prüfung bewertet, die Arzneimitteln vorbehalten ist, die eine signifikante Verbesserung der Sicherheit oder Sicherheit darstellen Wirksamkeit bei der Behandlung schwerer Krankheiten.
Der EMA-Überprüfungsprozess wird voraussichtlich in der ersten Hälfte des Jahres 2019 abgeschlossen sein. Derzeit gibt es keine von der EMA zugelassenen Behandlungen für fortgeschrittenes kutanes SCC.
Cemiplimab wird derzeit bei anderen Neoplasien untersucht. Es befindet sich in Phase III Entwicklung zum zervikal Krebs und basal Zellkarzinom und Entwicklung im Stadium II für andere Krebsarten, einschließlich Glioblastoma multiforme, Eierstock- und Prostatakrebs, und akut lymphozytisch Leukämie.
Die Einreichung von Zulassungsanträgen in anderen Ländern wird derzeit geprüft. Cemiplimab ist derzeit in Neuseeland nicht erhältlich.
Wie wirkt Cemiplimab?
Cemiplimab ist ein hochselektives humanisiertes Medikament. monoklonal Immunoglobulin G4 (IgG4) Antikörper zeigt Steuerung Inhibitor programmierter Zelltod Protein 1 (PD-1) und Ligand 2 (PD-L2), wodurch der PD-1-vermittelte Weg freigesetzt wird Hemmung der Immunantwort. Dazu gehört die Anti-Tumor Immunantwort, wodurch das Tumorwachstum verringert wird.
- Der Tod der PD-1 Empfänger ist eine Oberfläche Molekül Ausgedrückt Antigen-stimuliert T-Zellen.
- Im ungebundenen Zustand fungiert der PD-1-Rezeptor als Immun-Checkpoint-Rezeptor, der die T-Zell-Selbsttoleranz ermöglicht; somit verhindern Autoimmun Reaktionen.
- Allerdings unterdrückt die Bindung von PD-1 an seine Liganden, Ligand 1 (PD-L1) und Ligand 2 (PD-L2) des programmierten Zelltods, diese Immunantwort, indem nachgeschaltete Signalwege induziert werden, die den Zelltod hemmen. Proliferation von T-Zellen, Zytokin Freisetzung und Zytotoxizität.
- Eine abnormale Expression von PD-L1 auf der Oberfläche von Plattenepithelkarzinomen aktiviert PD-1 und unterdrückt es zytotoxisch T-Zelle Übung.
- Diese Toleranz gegenüber T-Zellen ermöglicht es Tumorzellen, die Erkennung und den Angriff des Immunsystems zu vermeiden.
Wie wird Cemiplimab verabreicht?
Die empfohlene Cemiplimab-Dosis beträgt 350 mg als intravenöse Infusion über 30 Minuten alle 3 Wochen, bis sich die Krankheitsprogression verlangsamt oder nicht mehr akzeptabel ist. Toxizität ist erreicht.
Dosisänderung
Schwere und tödliche immunvermittelte Nebenwirkungen kann das Aussetzen oder Absetzen von Cemiplimab erfordern.
Cemiplimab sollte unter folgenden Bedingungen abgesetzt werden:
- Note 2 Pneumonitis
- Klasse 2 oder 3 Kolitis
- Hepatitis (Aspartat-Transaminase [AST] oder Alanin [ALT]) um das >3- und ≤10-fache der Obergrenze des Normalwerts [ULN] oder insgesamt erhöht Bilirubin erhöht um das ≤3-fache der Obergrenze des Normalwerts)
- Klassen 2-4 Endokrinopathien (zurückhalten, wenn klinisch notwendig)
- Andere immunvermittelte Nebenwirkungen Grad 3, die ein wichtiges Organ betreffen.
Cemiplimab sollte unter folgenden Bedingungen dauerhaft abgesetzt werden:
- Pneumonitis 3. oder 4. Grades
- Colitis Grad 4
- Hepatitis (AST oder ALT um das >10-fache des ULN erhöht oder Gesamt-Bilirubin um das >3-fache des ULN erhöht)
- Infusionsbedingte Reaktionen 3. oder 4. Grades
- Wiederkehrend oder hartnäckig Immunvermittelte Nebenwirkungen (anhaltend für ≥ 12 Wochen nach der letzten Dosis oder Prednison ≥ 10 mg/Tag oder Äquivalent für ≥ 12 Wochen nach der letzten Cemiplimab-Dosis erforderlich).
Nieren Behinderung
Bei leichter oder mittelschwerer Nierenfunktionsstörung ist keine Dosisanpassung erforderlich, da keine klinisch relevanten Auswirkungen auf die Cemiplimab-Exposition beobachtet wurden Pharmakokinetik Bevölkerungsstudien.
Hepatisch Behinderung
Bei leichter Leberfunktionsstörung ist keine Dosisanpassung erforderlich, da keine klinisch bedeutsamen Auswirkungen auf die Cemiplimab-Exposition beobachtet wurden. Es liegen keine Studien bei Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung vor.
Welche Arzneimittelwechselwirkungen mit Cemiplimab sind möglich?
Mit Cemiplimab wurden keine formellen pharmakokinetischen Interaktionsstudien durchgeführt.
Was sind die möglichen Nebenwirkungen von Cemiplimab?
In klinischen Studien waren die häufigsten Nebenwirkungen (≥ 10%) bei Patienten, die Cemiplimab bis zu 3 mg/kg alle 2 Wochen erhielten:
- Ermüden
- Übelkeit
- Pruritus (hacken)
- Eruption (Nicht spezifiziert)
- Verminderter Appetit
- Verstopfung
- Durchfall.
Die häufigste (≥2%) schwere Arzneimittelnebenwirkungen mit Cemiplimab beobachtet wurden, waren die Harnwege Infektion, Septikämie, Lungenentzündung, Pneumonitis und Zellulitis. Cemiplimab kann auch Infusionsreaktionen hervorrufen, einschließlich Anaphylaxie.
Schwerwiegende und tödliche immunvermittelte Nebenwirkungen
- Cemiplimab bindet an den PD-1-Rezeptor, blockiert den PD-1/PD-L1-Weg und beseitigt so die Hemmung der Immunantwort mit dem Potenzial, sie zu stören peripher Toleranz (Management von T und B-Zellen zur Verhinderung von Autoimmunreaktionen) und die Induktion von immunvermittelten Nebenwirkungen.
- Immunvermittelte Pneumonitis, Colitis, Hepatitis, Endokrinopathien, Hypophysitis (Entzündung des Hypophyse Drüse), Hypothyreose oder Hyperthyreose, Diabetes mellitus Typ 1 und Nephritis wurden in klinischen Studien berichtet.
- Andere immunvermittelte Nebenwirkungen, die andere Systeme betreffen (z. B. neurologische, kardiovaskuläre und Okular Reaktionen) wurden in klinischen Studien auch bei weniger als 1%-Patienten berichtet.
- Klinisch-chemische Tests, einschließlich Lebertests und Schilddrüsenfunktionstests, sollten durchgeführt werden Base und periodisch während der Behandlung und bei Bedarf unverzüglich eine medizinische Behandlung eingeleitet.
Hautprobleme aufgrund von Cemiplimab
Anzeichen dieser Hautprobleme können sein:
- Eruption
- Juckreiz
- Verbrennung
- Schmerzlich Geschwüre im Mund-, Nasen-, Rachen- und Genitalbereich.
Welche Risiken birgt Cemiplimab?
Vor der Behandlung mit Cemiplimab sollte der Arzt informiert werden, wenn der Patient eines der folgenden Merkmale aufweist:
- Probleme des Immunsystems (z. B. Morbus Crohn, Colitis ulcerosa oder systemisch Lupus erythematodes)
- eine Orgelgeschichte Transplantation
- Atem- oder Lungenprobleme
- Leber- oder Nierenprobleme
- Geschichte von Diabetes
- schwanger sind oder planen, schwanger zu werden
- Sie stillen oder beabsichtigen zu stillen.
Die Anwendung von Cemiplimab in bestimmten Populationen
Schwangere Frau
- Aufgrund seines Wirkmechanismus kann Cemiplimab den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird.
- menschliches IgG4 Immunglobuline sie sind dafür bekannt, die Plazenta zu passieren; Daher kann Cemiplimab möglicherweise von der Mutter auf das Kind übertragen werden. Entwicklung Fötus.
- Tierstudien haben gezeigt, dass die Hemmung des PD-1/PD-L1-Signalwegs zu einem erhöhten Risiko einer immunvermittelten Abstoßung des sich entwickelnden Fötus führen kann, was zu einer Totgeburt führt.
- Es liegen keine Daten zur Anwendung von Cemiplimab bei Schwangeren vor.
Stillende Mutter
Es ist nicht bekannt, ob Cemiplimab oder seine Metaboliten werden in die Muttermilch ausgeschieden. Da viele Medikamente in die Muttermilch übergehen, sollten Mütter vor der Anwendung von Cemiplimab mit dem Stillen aufhören.
Weibchen mit Fortpflanzungspotential
Frauen im gebärfähigen Alter sollte geraten werden, während der Behandlung mit Cemiplimab und für mindestens 4 Monate nach der letzten Dosis des Arzneimittels eine wirksame Verhütungsmethode anzuwenden.
Kinder
Die Sicherheit und Wirksamkeit von Cemiplimab bei Kindern ist nicht erwiesen.
Alte Leute
In klinischen Studien waren von den 163 Patienten mit lokal fortgeschrittenem und metastasiertem kutanem SCC, die Cemiplimab erhielten, 72% 65 Jahre oder älter und 37% 75 Jahre oder älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen und jüngeren Patienten beobachtet.