Invoering
Adalimumab behoort tot de klasse van biologische geneesmiddelen die worden genoemd tumor necrose factorTNFa) blokkers. Het is goedgekeurd bij volwassenen en kinderen ouder dan 4 jaar voor de behandeling van psoriasis, psoriatica. artritis, polyarticulair jeugd idiopathisch artritis, spondylitis ankylopoetica, reumatoïde artritis, ulceratief colitis en de ziekte van Crohn, en uveïtis. In september 2015 keurde de FDA ook adalimumab goed voor de behandeling van hidradenitis suppurativa. In Nieuw-Zeeland (oktober 2019) keurde PHARMAC de financiering goed op de toepassing van bijzondere bevoegdheid in bepaalde omstandigheden voor ernstige refractaire psoriasis, matige tot ernstige hidradenitis suppurativa, Behcet syndroom Y pyodermie gangreneus.
Het oorspronkelijke merk adalimumab heeft de handelsnaam Humira®. Ook de generieke biosimilar adalimumab wordt in verschillende landen op de markt gebracht.
Hoe effectief is adalimumab bij psoriasis?
Adalimumab is onderzocht bij enkele duizenden volwassen patiënten met matige tot ernstige psoriasis. de effectiviteit van medicatie werd beoordeeld met behulp van PASI (Psoriasis Area and Severity Index) vóór de behandeling en na gebruik van adalimumab 40 mg om de 2 weken. Meer dan 70% van de patiënten bereikte een 75% verlaging van de PASI-score na 16 weken en bij 15-20% verdween hun psoriasis volledig.
Adalimumab geneest psoriasis niet en moet langdurig worden voortgezet. Hoewel het bij de meeste patiënten effectief blijft, komt psoriasis soms terug ondanks aanhoudende adalimumab-injecties. Dit wordt een secundaire fout genoemd.
Adalimumab 40 mg om de 2 weken is ook onderzocht bij enkele honderden patiënten met artritis psoriatica. Bij de meeste patiënten is er enige verbetering in gewrichtspijn en zwelling in ten minste enkele aangetaste gewrichten, en sommige patiënten melden een duidelijk voordeel van de behandeling.
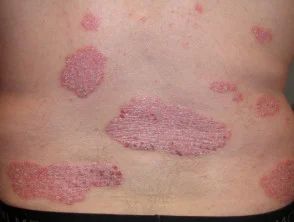
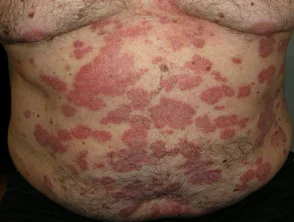
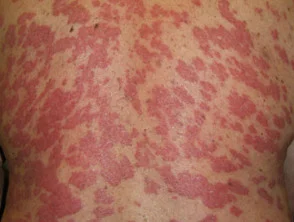
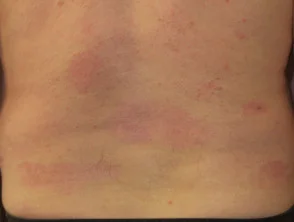
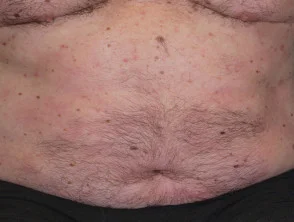
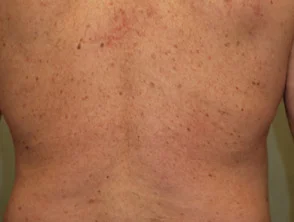
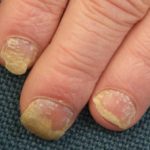
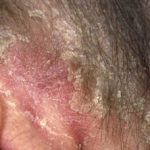
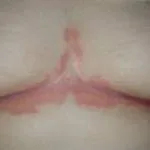
Psoriasis voor en 6 maanden na het starten met adalimumab
Psoriasis voordat u met adalimumab begint
Psoriasis voordat u met adalimumab begint
Psoriasis voordat u met adalimumab begint
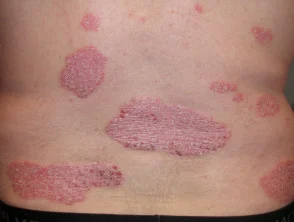
Psoriasis 6 maanden na het starten met adalimumab
Psoriasis 6 maanden na het starten met adalimumab
Psoriasis 6 maanden na het starten met adalimumab
Bekijk meer afbeeldingen van psoriasis behandeld met adalimumab.
Hoe werkt adalimumab?
Adalimumab is een recombinant monoklonaal antilichaam die alleen mensen bevat peptiden. Het werkt door rechtstreeks aan TNF te binden moleculen in bloed en ziek weefsel. TNF gebonden aan adalimumab wordt voorkomen ontsteking wat resulteert in psoriasis platen.
Adalimumab is ook effectief voor anderen opruiend Huidziektes; is geregistreerd voor de behandeling van hidradenitis suppurativa. In Nieuw-Zeeland wordt het gefinancierd om sommige gevallen van te behandelen Behcet ziekte en pyoderma gangrenosum.
Hoe wordt adalimumab toegediend?
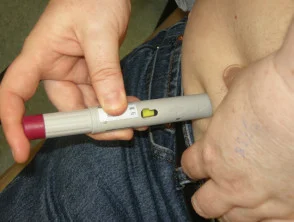
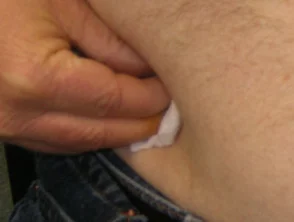
Adalimumab wordt toegediend door onderhuids injectie eenmaal per twee weken. Het is verkrijgbaar als kant-en-klare spuit of pen. Na initiële counseling en training kunnen patiënten gewoonlijk zelf injecteren in de dij of buik. Voor elke injectie moet een andere injectieplaats worden gebruikt om pijn te verminderen en te voorkomen dat de huid gevoelig, rood, blauwe plekken of hard wordt.
Behandeling met adalimumab
pendoppen verwijderen
Subcutane injectie geven
Drukken op de injectieplaats
De aanbevolen dosis voor de behandeling van psoriasis is 80 mg en vervolgens 40 mg een week later, gevolgd door 40 mg om de twee weken als een enkele dosis.
Andere medicijnen, waaronder methotrexaat en acitretine, kunnen gewoonlijk worden voortgezet tijdens de behandeling met adalimumab.
Proeven voorafgaand aan adalimumab
dermatologen ze zullen waarschijnlijk een volledig bloedbeeld, lever en nier functie, snel lipiden en antinucleaire antilichamen (ANA) voordat u met adalimumab begint. Bij vrouwen kan een zwangerschapstest aangewezen zijn.
Patiënten moeten worden gescreend op tuberculose (tbc), actieve of latent viraal hepatitis (HAV, HBV, HCV) en humaan immunodeficiëntievirus (hiv). Indien aanwezig, deze infecties moet worden behandeld voordat met adalimumab wordt begonnen.
Vaccins en adalimumab
De vaccinatiestatus moet worden gecontroleerd voordat met adalimumab wordt begonnen. Indien nodig moeten de vaccinaties voorafgaand aan de behandeling worden bijgewerkt. Jaarlijkse griepvaccinatie wordt aanbevolen.
Aangezien ze bij immuungecompromitteerde personen ziekte kunnen veroorzaken, mogen tijdens de behandeling met adalimumab geen levende vaccins worden gebruikt. Momenteel beschikbare levende verzwakte virale vaccins omvatten mazelen, bof, rubella, varicella, geel koorts, griep (intranasaal vaccin) en oraal poliovaccin. gedimd leven bacterieel Vaccins omvatten BCG en het orale tyfusvaccin.
Lees meer over vaccinatie in immunosuppressie dermatologie patiënten.
Voorzorgsmaatregelen tijdens de behandeling met adalimumab
infecties
Omdat adalimumab werkt door zich selectief op TNF te richten, zou het in theorie niet veel effect moeten hebben op de rest van het immuunsysteem van het lichaam. Voorzichtigheid is echter geboden bij het overwegen van het gebruik ervan bij patiënten die vatbaar zijn voor infectie of bij patiënten met chronisch of terugkerend infecties Gelijktijdig behandeling met corticosteroïden, azathioprine of ciclosporine verhoogt het risico op infectie. De infectie kan het gevolg zijn van bacteriën, mycobacteriën, invasief paddenstoelenverspreid of extrapulmonale histoplasmose, aspergillose, coccidioidomycose), virussen, parasieten of andere opportunistische infectieuze agentia.
Er bestaat met name bezorgdheid dat etanercept tuberculose (tbc) (inclusief het risico op Bacillus Calmette-Guérin [BCG]), virale hepatitis B en C kan reactiveren en het risico op infecties met het humaan immunodeficiëntievirus (hiv), listeria en legionella kan verhogen.
Immunisatie met levende vaccins (zoals gele koorts, waterpokken, gordelroos, bof/mazelen/rubella [MMR], BCG) moet worden vermeden.
Andere risico's
Adalimumab moet ook met voorzichtigheid worden gebruikt in de volgende situaties:
- Congestief hartfalen: mag niet worden gebruikt door patiënten met matig of ernstig hartfalen.
- Reeds bestaand of recent gestart CZS demyeliniserende aandoeningen (bijv. multipele sclerose)
- huid patiënten kanker of met een hoog risico op huidkanker
- Patiënten met een voorgeschiedenis van kanker
Aan patiënten die anakinra gebruiken, een geneesmiddel dat wordt gebruikt bij reumatoïde artritis, mag adalimumab niet worden voorgeschreven.
De veiligheid van adalimumab tijdens zwangerschap en borstvoeding is niet bekend. Daarom wordt het niet aanbevolen. Indien mogelijk moet het medicijn enkele maanden voor de conceptie worden gestopt.
Patiënten die een grote operatie moeten ondergaan, kunnen worden geadviseerd om 2 tot 3 maanden voor een geplande operatie tijdelijk te stoppen met adalimumab. Het kan 2 weken na de operatie opnieuw worden gestart, zolang er geen infectie is.
Bijwerkingen van adalimumab
Adalimumab lijkt goed te worden verdragen. Milde tot matige reacties op de injectieplaats (roodheid, zwelling, jeuk, pijn) lijken de meest voorkomende bijwerking te zijn die optreedt bij 20%-patiënten. Milde tot ernstige infecties vormen het belangrijkste risico van behandeling en moeten onmiddellijk worden behandeld.
Echt huid reacties, waaronder verergering van psoriasis, zijn zelden gemeld vasculitis, anafylaxie, Stevens-Johnson-syndroom en giftig epidermaal necrolyse.
Zoals alle geneesmiddelen die op het immuunsysteem werken, kan het het risico op bepaalde soorten van lymfoom (kanker van witte bloedcellen). Deze zijn zelden gemeld bij patiënten die adalimumab gebruikten, meestal bij patiënten die ook andere geneesmiddelen gebruikten die het immuunsysteem onderdrukken, zoals azathioprine of mercaptopurine.
Vooral huidkanker geschubd cel carcinoom, zijn ook gemeld bij patiënten die adalimumab kregen, meestal bij patiënten met andere risicofactoren zoals door de zon beschadigde huid of eerdere behandeling met fotochemotherapie (PUVA).
Monitoring tijdens het gebruik van adalimumab
Regelmatige vervolgbezoeken zijn nodig om de veiligheid en werkzaamheid van de behandeling te controleren. Het wordt aanbevolen dat patiënten die biologische geneesmiddelen gebruiken ongeveer elke 6 maanden een routinematig bloedonderzoek ondergaan, inclusief volledige bloedtellingen en leverfunctietesten. Tuberculosetests moeten ook van tijd tot tijd worden herhaald.
Adalimumab-bloedspiegels kunnen worden gebruikt om therapietrouw te controleren en de optimale dosis voor een persoon te bepalen.
stoppen met adalimumab
De behandeling met adalimumab moet worden gestaakt in de volgende omstandigheden:
- Nieuwe ernstige infectie (kan herstarten wanneer infectie is verdwenen)
- onverklaarbaar ernstig systemisch symptomen die kunnen worden veroorzaakt door een infectie
- Kortademigheid of andere symptomen als gevolg van hartfalen of chronische obstructieve longziekte
- Enkele electieve chirurgische ingrepen: Richtlijnen variëren van het niet stoppen van de behandeling tot een maand voor een electieve operatie. Het kan postoperatief worden hervat als er geen infectie is en de wondgenezing bevredigend is.
- Ontwikkelen kanker, waaronder lymfoom, stevig kanker, Merkel cel carcinoom (een agressieve vorm van huidkanker geassocieerd met immunosuppressie), of meerdere plaveiselcellen carcinomen. basaal Cellulair carcinoom leidt meestal niet tot stopzetting van de behandeling met adalimumab.