introduzione
Adalimumab appartiene a una classe di farmaci biologici chiamati tumore necrosi fattoreTNF) bloccanti. È approvato negli adulti e nei bambini di età superiore ai 4 anni per il trattamento della psoriasi, psoriasica. artrite, poliarticolare gioventù idiopatico artrite, spondilite anchilosante, artrite reumatoide, ulcerosa colite e morbo di Crohn, e uveite. Nel settembre 2015, la FDA ha anche approvato adalimumab per il trattamento dell'idrosadenite suppurativa. In Nuova Zelanda (ottobre 2019), PHARMAC ha approvato il finanziamento sull'applicazione dell'autorizzazione speciale in determinate circostanze per la psoriasi grave resistente al trattamento, l'idrosadenite suppurativa da moderata a grave, Behcet sindrome e piodermite cancrenoso.
Il nome commerciale originale di adalimumab ha il nome commerciale Humira®. L'adalimumab biosimilare generico è anche commercializzato in diversi paesi.
Quanto è efficace adalimumab nella psoriasi?
Adalimumab è stato studiato in diverse migliaia di pazienti adulti con psoriasi da moderata a grave. il efficacia di farmaci è stato giudicato utilizzando PASI (Psoriasis Area and Severity Index) prima del trattamento e dopo l'uso di adalimumab 40 mg ogni 2 settimane. Più di 70% dei pazienti hanno ottenuto una riduzione di 75% nel punteggio PASI a 16 settimane e nel 15-20% la psoriasi è scomparsa completamente.
Adalimumab non cura la psoriasi e deve essere continuato a lungo termine. Sebbene ancora efficace nella maggior parte dei pazienti, la psoriasi a volte ritorna nonostante le iniezioni di adalimumab in corso. Questo è chiamato difetto secondario.
Adalimumab 40 mg ogni 2 settimane è stato anche studiato in diverse centinaia di pazienti con artrite psoriasica. La maggior parte dei pazienti ha un certo sollievo dal dolore articolare e dal gonfiore almeno in alcune articolazioni colpite e alcuni pazienti riferiscono un notevole beneficio dal trattamento.
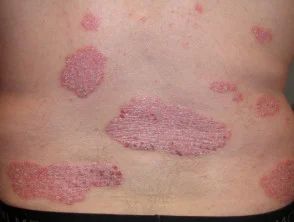
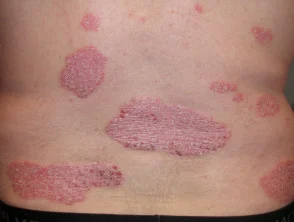
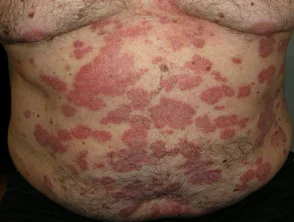
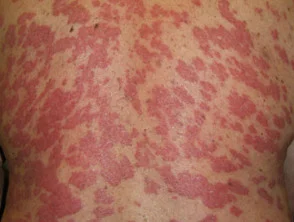
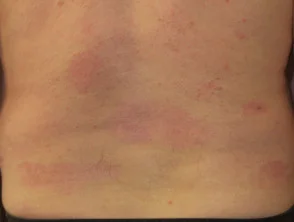
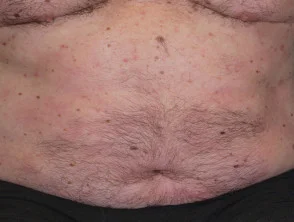
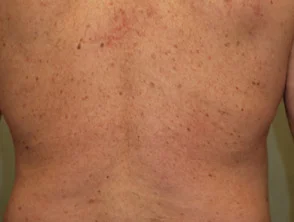
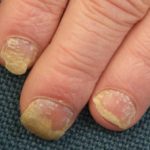
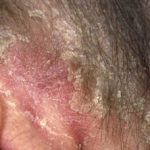
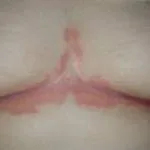
Psoriasi prima e 6 mesi dopo l'inizio di adalimumab
Psoriasi prima di iniziare a prendere adalimumab
Psoriasi prima di iniziare a prendere adalimumab
Psoriasi prima di iniziare a prendere adalimumab
Psoriasi 6 mesi dopo l'inizio di adalimumab
Psoriasi 6 mesi dopo l'inizio di adalimumab
Psoriasi 6 mesi dopo l'inizio di adalimumab
Guarda altre foto della psoriasi trattata con adalimumab.
Come funziona adalimumab?
Adalimumab è un ricombinante monoclonale anticorpo contenente solo esseri umani peptidi. Funziona legandosi direttamente a TNF molecole nel sangue e nei tessuti malati. Si impedisce che il TNF legato ad adalimumab possa causare infiammazione con conseguente psoriasi piatti.
Adalimumab è efficace anche per gli altri infiammatorio Malattie della pelle; È registrato per il trattamento dell'idrosadenite suppurativa. In Nuova Zelanda, è finanziato per trattare alcuni casi di Behçet malattia e pioderma gangrenoso.
Come viene somministrato adalimumab?
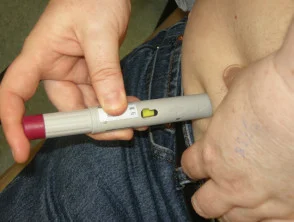
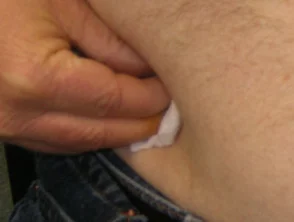
Adalimumab è somministrato da sottocutaneo iniezione una volta ogni due settimane. È disponibile come siringa o penna pre-preparata. Dopo la consulenza e l'addestramento iniziali, i pazienti di solito possono autoiniettarsi nella coscia o nell'addome. Per ogni iniezione deve essere utilizzato un sito diverso per ridurre il dolore e impedire che la pelle diventi sensibile, arrossata, livida o indurita.
Trattamento con adalimumab
Rimuovere i cappucci della penna
Dare l'iniezione sottocutanea
Premendo sul sito di iniezione
La dose raccomandata per il trattamento della psoriasi è di 80 mg e poi di 40 mg una settimana dopo, seguita da 40 mg ogni 15 giorni come dose singola.
Altri farmaci, inclusi metotrexato e acitretina, possono generalmente essere continuati durante il trattamento con adalimumab.
Test prima di adalimumab
Dermatologi è probabile che richiedano emocromo, fegato e renale funzione, digiuno lipidi e anticorpi antinucleari (ANA) prima di iniziare a prendere adalimumab. Nelle donne può essere appropriato un test di gravidanza.
I pazienti devono essere sottoposti a screening per la tubercolosi (TB), attiva o latente virale epatite (HAV, HBV, HCV) e virus dell'immunodeficienza umana (HIV). Se presenti, questi infezioni deve essere trattato prima di iniziare a prendere adalimumab.
Vaccini e adalimumab
Lo stato della vaccinazione deve essere controllato prima di iniziare adalimumab. Se necessario, le vaccinazioni devono essere aggiornate prima del trattamento. Si raccomanda la vaccinazione antinfluenzale annuale.
Poiché possono indurre la malattia in individui immunocompromessi, i vaccini vivi non devono essere utilizzati durante il trattamento con adalimumab. I vaccini virali vivi attenuati attualmente disponibili includono morbillo, parotite, rosolia, varicella, giallo febbre, influenza (vaccino intranasale) e vaccino antipolio orale. Vita attenuata batterica I vaccini includono BCG e il vaccino contro il tifo orale.
Maggiori informazioni sull'immunizzazione su immunosoppressi dermatologia pazienti.
Precauzioni durante il trattamento con adalimumab
Infezioni
Poiché adalimumab agisce mirando selettivamente al TNF, in teoria non dovrebbe avere un grande effetto sul resto del sistema immunitario del corpo. Tuttavia, è necessario prestare attenzione quando si considera il suo utilizzo in pazienti inclini alle infezioni o in quelli con cronica o ricorrente Infezioni Concorrente trattamento con corticosteroidi, azatioprina o ciclosporina aumenta il rischio di infezione. L'infezione può essere dovuta a batteri, micobatteri, invasivo funghidiffuso o istoplasmosi extrapolmonare, aspergillosi, coccidioidomicosi), virus, agenti infettivi parassitari o altri agenti opportunistici.
Vi è una particolare preoccupazione che etanercept possa riattivare la tubercolosi (TB) (compreso il rischio di Bacillus Calmette-Guérin [BCG]), l'epatite virale B, C e aumentare il rischio di infezioni da virus dell'immunodeficienza umana (HIV), listeria e legionella.
L'immunizzazione con vaccini vivi (come febbre gialla, varicella, herpes zoster, parotite / morbillo / rosolia [MMR], BCG) deve essere evitata.
Altri rischi
Adalimumab deve essere usato con cautela anche nelle seguenti situazioni:
- Insufficienza cardiaca congestizia: non deve essere utilizzato da pazienti con insufficienza cardiaca moderata o grave.
- Preesistente o avviato di recente CNS disturbi demielinizzanti (p. es., multiple sclerosi)
- Pazienti con pelle Cancro o ad alto rischio di cancro della pelle
- Pazienti con una storia di cancro
Ai pazienti che assumono anakinra, un farmaco usato nell'artrite reumatoide, non deve essere prescritto adalimumab.
La sicurezza di adalimumab durante la gravidanza e l'allattamento non è nota. Pertanto, non è consigliato. Quando possibile, il farmaco deve essere sospeso diversi mesi prima del concepimento.
Ai pazienti che richiedono un intervento chirurgico maggiore può essere consigliato di interrompere temporaneamente adalimumab 2-3 mesi prima di un'operazione pianificata. Può essere riavviato 2 settimane dopo l'intervento, purché non vi siano infezioni.
Effetti avversi di adalimumab
Adalimumab sembra essere ben tollerato. Le reazioni al sito di iniezione da lievi a moderate (arrossamento, gonfiore, prurito, dolore) sembrano essere l'effetto indesiderato più comune, che si verificano nei pazienti 20%. Le infezioni da lievi a gravi sono il rischio principale del trattamento e devono essere trattate immediatamente.
Grave cutaneo reazioni, compreso il peggioramento della psoriasi, sono state riportate raramente vasculite, anafilassi, Sindrome di Stevens-Johnson e tossico epidermico necrolisi.
Come tutti i medicinali che agiscono sul sistema immunitario, può aumentare il rischio di alcuni tipi di linfoma (cancro dei globuli bianchi). Questi sono stati riportati raramente in pazienti che assumono adalimumab, di solito in coloro che assumono anche altri farmaci che sopprimono il sistema immunitario, come l'azatioprina o la mercaptopurina.
Tumori della pelle, in particolare, squamoso cellula carcinoma, sono stati riportati anche in pazienti in trattamento con adalimumab, generalmente in pazienti con altri fattori di rischio come pelle danneggiata dal sole o precedente trattamento con fotochemioterapia (PUVA).
Monitoraggio durante l'assunzione di adalimumab
Sono necessarie visite di follow-up regolari per monitorare la sicurezza e l'efficacia del trattamento. Si raccomanda ai pazienti che assumono farmaci biologici di sottoporsi a esami del sangue di routine ogni 6 mesi circa, inclusi emocromo completo e test di funzionalità epatica. Anche i test per la tubercolosi dovrebbero essere ripetuti di tanto in tanto.
I livelli ematici di adalimumab possono essere utilizzati per monitorare la compliance alla terapia e determinare la dose ottimale in un individuo.
Interruzione del trattamento con adalimumab
Adalimumab deve essere interrotto nelle seguenti circostanze:
- Nuova infezione grave (può riavviarsi quando l'infezione si è risolta)
- Inspiegabile grave sistemico sintomi che possono essere dovuti a infezione
- Mancanza di respiro o altri sintomi dovuti a insufficienza cardiaca o malattia polmonare ostruttiva cronica
- Alcune procedure chirurgiche elettive: le linee guida vanno da nessuna interruzione del trattamento a un mese prima della chirurgia elettiva. Può essere riavviato dopo l'operazione se non c'è infezione e la guarigione della ferita è soddisfacente.
- Sviluppo cancro, incluso linfoma, solido Cancro, La cellula di Merkel carcinoma (una forma aggressiva di cancro della pelle associata a immunosoppressione) o più cellule squamose carcinomi. Basale Il carcinoma cellulare di solito non porta all'interruzione del trattamento con adalimumab.