Introducción
Adalimumab pertenece a la clase de medicamentos biológicos denominados tumor necrosis factorTNF) bloqueadores. Está aprobado en adultos y niños mayores de 4 años para el tratamiento de la psoriasis, psoriásica. artritis, poliarticular juvenil idiopático artritis, espondilitis anquilosante, artritis reumatoide, ulcerativa colitis y enfermedad de Crohn, y uveítis. En septiembre de 2015, la FDA también aprobó el adalimumab para el tratamiento de la hidradenitis supurativa. En Nueva Zelanda (octubre de 2019), PHARMAC aprobó la financiación sobre la aplicación de autoridad especial en determinadas circunstancias para psoriasis severa resistente al tratamiento, hidradenitis supurativa de moderada a severa, Behcet síndrome y pioderma gangrenoso.
La marca original de adalimumab tiene el nombre comercial Humira®. El adalimumab biosimilar genérico también se comercializa en varios países.
¿Qué tan efectivo es el adalimumab en la psoriasis?
Adalimumab se ha estudiado en varios miles de pacientes adultos con psoriasis de moderada a grave. los eficacia de la medicación se juzgó utilizando PASI (Psoriasis Area and Severity Index) antes del tratamiento y después de usar adalimumab 40 mg cada 2 semanas. Más del 70% de los pacientes lograron una reducción del 75% en la puntuación PASI a las 16 semanas y en un 15-20% la psoriasis desapareció por completo.
El adalimumab no cura la psoriasis y debe continuarse a largo plazo. Aunque sigue siendo eficaz en la mayoría de los pacientes, a veces la psoriasis reaparece a pesar de las inyecciones de adalimumab en curso. A esto se le llama falla secundaria.
También se ha estudiado adalimumab 40 mg cada 2 semanas en varios cientos de pacientes con artritis psoriásica. La mayoría de los pacientes mejoran un poco el dolor y la hinchazón de las articulaciones al menos en algunas articulaciones afectadas y algunos pacientes informan de un beneficio notable del tratamiento.
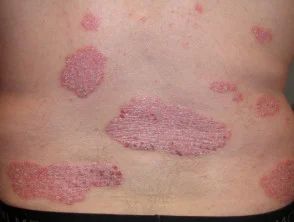
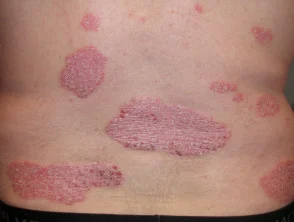
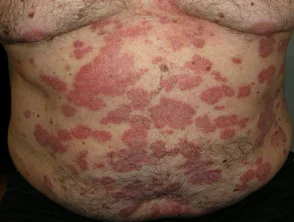
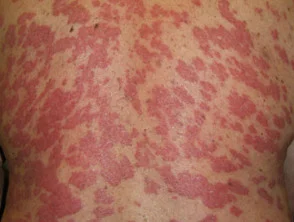
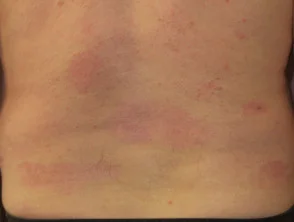
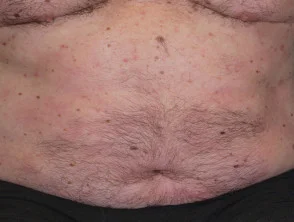
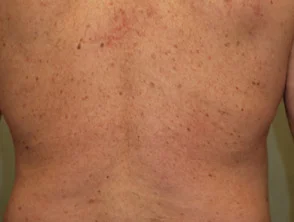
Psoriasis antes y 6 meses después de comenzar con adalimumab
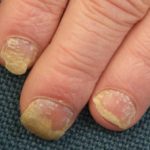
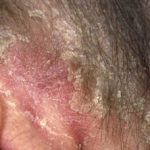
Psoriasis antes de comenzar a tomar adalimumab
Psoriasis antes de comenzar a tomar adalimumab
Psoriasis antes de comenzar a tomar adalimumab
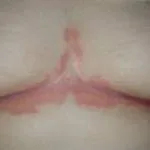
Psoriasis 6 meses después de comenzar con adalimumab
Psoriasis 6 meses después de comenzar con adalimumab
Psoriasis 6 meses después de comenzar con adalimumab
Vea más imágenes de la psoriasis tratada con adalimumab.
¿Cómo actúa el adalimumab?
El adalimumab es un recombinante monoclonal anticuerpo que contiene solo humanos péptidos. Funciona uniéndose directamente al TNF moléculas en la sangre y tejido enfermo. Se evita que el TNF unido a adalimumab cause la inflamación que resulta en psoriasis placas.
El adalimumab también es eficaz para otros inflamatorio Enfermedades de la piel; está registrado para el tratamiento de la hidradenitis supurativa. En Nueva Zelanda, está financiado para tratar algunos casos de Behçet enfermedad y pioderma gangrenoso.
¿Cómo se administra adalimumab?
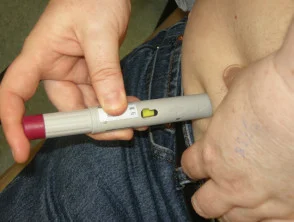
El adalimumab es administrado por subcutáneo inyección una vez cada dos semanas. Está disponible como jeringa o pluma preparada previamente. Después del asesoramiento y el entrenamiento iniciales, los pacientes generalmente pueden autoinyectarse en el muslo o el abdomen. Se debe usar un lugar diferente en cada inyección para reducir el dolor y evitar que la piel se vuelva sensible, enrojecida, amoratada o dura.
Tratamiento con adalimumab
Quitar las tapas de la pluma
Dar la inyección subcutánea
Presionando en el lugar de la inyección
La dosis recomendada para el tratamiento de la psoriasis es de 80 mg y luego 40 mg una semana después, seguidos de 40 mg cada quince días como dosis única.
Otros medicamentos, incluidos metotrexato y acitretina, generalmente se pueden continuar durante el tratamiento con adalimumab.
Pruebas previas a adalimumab
Dermatólogos es probable que soliciten hemograma, hígado y renal función, ayuno lípidos y anticuerpos antinucleares (ANA) antes de comenzar a tomar adalimumab. En las mujeres, una prueba de embarazo puede ser apropiada.
Los pacientes deben someterse a exámenes de detección de tuberculosis (TB), activos o latente viral hepatitis (VHA, VHB, VHC) y virus de inmunodeficiencia humana (VIH). Si está presente, estos infecciones debe tratarse antes de comenzar a tomar adalimumab.
Vacunas y adalimumab
Se debe revisar el estado de vacunación antes de comenzar a tomar adalimumab. Si es necesario, las vacunas deben actualizarse antes del tratamiento. Se recomienda la vacunación anual contra la influenza.
Como pueden inducir enfermedades en individuos inmunodeficientes, no se deben utilizar vacunas vivas durante el tratamiento con adalimumab. Actualmente, las vacunas virales vivas atenuadas disponibles incluyen sarampión, paperas, rubéola, varicela, amarillo fiebre, influenza (vacuna intranasal) y la vacuna oral contra la polio. Vida atenuada bacteriano las vacunas incluyen BCG y la vacuna oral contra la fiebre tifoidea.
Leer más sobre inmunización en inmunosuprimido dermatología pacientes.
Precauciones durante el tratamiento con adalimumab
Infecciones
Debido a que el adalimumab actúa dirigiéndose selectivamente al TNF, teóricamente no debería tener mucho efecto en el resto del sistema inmunológico del cuerpo. Sin embargo, se debe tener precaución al considerar su uso en pacientes propensos a infecciones o en aquellos con crónico o recurrente Infecciones Concurrente tratamiento con corticosteroides, azatioprina o ciclosporina aumenta el riesgo de infección. La infección puede deberse a bacterias, micobacterias, invasor hongosdiseminado o histoplasmosis extrapulmonar, aspergilosis, coccidioidomicosis), virus, parasitarios u otros agentes infecciosos oportunistas.
Existe una preocupación particular de que etanercept pueda reactivar la tuberculosis (TB) (incluido el riesgo de Bacillus Calmette-Guérin [BCG]), hepatitis viral B, C y aumentan el riesgo de infecciones por el virus de la inmunodeficiencia humana (VIH), listeria y legionella.
Inmunización con vacunas vivas (como fiebre amarilla, varicela, herpes zóster, paperas / sarampión / rubéola [MMR], BCG) deben evitarse.
Otros riesgos
El adalimumab también debe usarse con precaución en las siguientes situaciones:
- Insuficiencia cardíaca congestiva: no debe ser utilizado por pacientes con insuficiencia cardíaca moderada o grave.
- Preexistente o de inicio reciente SNC trastornos desmielinizantes (p. ej., múltiples esclerosis)
- Pacientes con piel cáncer o con alto riesgo de cáncer de piel
- Pacientes con antecedentes de cáncer
A los pacientes que toman anakinra, un fármaco utilizado en la artritis reumatoide, no se les debe recetar adalimumab.
Se desconoce la seguridad de adalimumab durante el embarazo y la lactancia. Por tanto, no se recomienda. Siempre que sea posible, el medicamento debe suspenderse varios meses antes de la concepción.
A los pacientes que requieren cirugía mayor se les puede recomendar que suspendan el adalimumab temporalmente 2 a 3 meses antes de una operación planificada. Puede reiniciarse 2 semanas después de la cirugía siempre que no haya infección.
Efectos adversos del adalimumab
El adalimumab parece ser bien tolerado. Las reacciones leves a moderadas en el lugar de la inyección (enrojecimiento, hinchazón, picazón, dolor) parecen ser el efecto secundario más común, que ocurre en el 20% de los pacientes. Las infecciones leves a graves son el principal riesgo del tratamiento y deben tratarse de inmediato.
Grave cutáneo raras veces se han notificado reacciones, incluido el empeoramiento de la psoriasis, vasculitis, anafilaxia, Síndrome de Stevens-Johnson y tóxico epidérmico necrólisis.
Como todos los medicamentos que actúan sobre el sistema inmunológico, puede aumentar el riesgo de ciertos tipos de linfoma (cáncer de glóbulos blancos). Éstos se han notificado raramente en pacientes que toman adalimumab, generalmente en aquellos que también toman otros medicamentos que inhiben el sistema inmunológico, como azatioprina o mercaptopurina.
Los cánceres de piel, en particular, escamoso célula carcinoma, también se han notificado en pacientes en tratamiento con adalimumab, generalmente en pacientes con otros factores de riesgo como piel dañada por el sol o tratamiento previo con fotoquimioterapia (PUVA).
Monitoreo mientras toma adalimumab
Son necesarias visitas de seguimiento regulares para controlar la seguridad y eficacia del tratamiento. Se recomienda que los pacientes que toman medicamentos biológicos se realicen análisis de sangre de rutina cada 6 meses aproximadamente, incluidos hemogramas completos y pruebas de función hepática. Las pruebas de tuberculosis también deben repetirse de vez en cuando.
Los niveles sanguíneos de adalimumab pueden usarse para monitorear el cumplimiento de la terapia y determinar la dosis óptima en un individuo.
Interrupción de adalimumab
Se debe interrumpir el tratamiento con adalimumab en las siguientes circunstancias:
- Nueva infección grave (puede reiniciarse cuando la infección se haya resuelto)
- Grave inexplicable sistémico síntomas que pueden deberse a una infección
- Falta de aliento u otros síntomas debido a insuficiencia cardíaca o enfermedad pulmonar obstructiva crónica
- Algunos procedimientos quirúrgicos electivos: las pautas varían desde no interrumpir el tratamiento hasta un mes antes de la cirugía electiva. Se puede reiniciar después de la operación si no hay infección y la cicatrización de la herida es satisfactoria.
- Desarrollo de cáncer, incluido el linfoma, sólido cáncer, Celda de Merkel carcinoma (una forma agresiva de cáncer de piel asociada con inmunosupresión), o múltiples células escamosas carcinomas. Basal El carcinoma celular no suele dar lugar a la interrupción del tratamiento con adalimumab.