introduzione
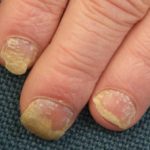
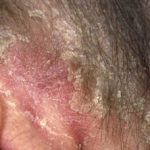
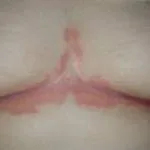
Nel marzo 2018, il trattamento biologico tildrakizumab (Ilumya ™; Sun Pharma India) ha ricevuto l'approvazione dalla Food and Drug Administration (FDA) statunitense per il trattamento di malattie da moderate a gravi. targa psoriasi in pazienti che sono candidati per sistemico terapia o fototerapia. Licenza Sun Pharma monoclonale anticorpo (un farmaco biologico), che si lega selettivamente alla subunità p19 di interleuchina 23 (IL-23) e inibisce la sua interazione con IL-23 ricevitoreda Merck and Co. (New Jersey, USA) nel 2014.
L'approvazione della FDA era basata sulla sicurezza e efficacia dati dagli studi clinici di fase III di reSURFACE, che collegavano tildrakizumab a miglioramenti significativi sia nell'area della psoriasi che nell'indice di gravità (PASI) e Physician's Global Assessment (PGA) alla settimana 12, rispetto a placebo.
Consulta la nostra pagina sulle principali prove di studi clinici per tildrakizumab.
Almirall ha i diritti su sviluppare e commercializzare il farmaco in Europa. Attualmente, l'Agenzia europea per i medicinali sta esaminando una domanda che richiede l'approvazione del medicinale in Europa. Tildrakizumab non è attualmente disponibile in Nuova Zelanda (2018).
Come funziona tildrakizumab?
Tildrakizumab è un monoclonale umano immunoglobuline Anticorpo G1 lambda (IgG1λ) che si lega selettivamente alla subunità p19 di IL-23 e inibisce la sua interazione con il recettore IL-23.
IL-23 promuove la normalità infiammatorio e risposte immunitarie. Psoriasi e altri autoimmune Le malattie infiammatorie della pelle sono il risultato della sovraespressione delle subunità p19 e p40 di IL-23. Tildrakizumab si lega selettivamente alla subunità p19 di IL-23 in cellule dendritiche e cheratinociti, bloccando la sua interazione con i recettori IL-23 e prevenendo il rilascio di pro-infiammatori citochine e chemochine.
Tildrakizumab blocca così la segnalazione anormalmente intensificata delle cascate infiammatorie (l'effetto della reazione a catena che avvia la risposta infiammatoria) che promuove iperproliferazione (alti tassi di divisione cellulare) dei cheratinociti e formazione psoriasica piatti.
Come viene somministrato tildrakizumab?
Tildrakizumab deve essere somministrato sottocutaneo iniezione sotto la guida e la supervisione di un medico. La dose raccomandata è di 100 mg alla settimana 0 e alla settimana 4 e successivamente ogni 12 settimane.
Il trattamento con tildrakizumab non deve essere iniziato nei pazienti con qualsiasi ingrediente attivo clinicamente importante. infezione fino alla risoluzione o al trattamento appropriato dell'infezione. La dose dimenticata deve essere iniettata non appena se ne ricorda e la dose successiva deve essere assunta all'orario previsto.
Tildrakizumab non deve essere iniettato in aree dove la pelle è sensibile, livida, rossa, dura, spessa, squamoso, o affetto da psoriasi, poiché può aumentare il rischio di infezione.
Valutazione pretrattamento per tubercolosi e immunizzazione
I pazienti in corso di valutazione per il trattamento con tildrakizumab devono essere sottoposti a screening per la tubercolosi e il loro stato di immunizzazione deve essere riesaminato. Vedi la nostra pagina sull'immunizzazione su immunosoppressi dermatologia pazienti.
- Pazienti il cui rilevamento della tubercolosi è positivo o che hanno una storia di latente la tubercolosi deve essere adeguatamente trattata prima della somministrazione di tildrakizumab, poiché il farmaco può riattivare la tubercolosi.
- I pazienti non devono essere immunizzati con vaccini vivi durante il trattamento con tildrakizumab.
L'uso di tildrakizumab in popolazioni specifiche
Donne incinte
- I dati limitati disponibili sull'uso di tildrakizumab nelle donne in gravidanza non indicano un rischio associato al farmaco di gravi difetti alla nascita e di aborto spontaneo.
- È noto che le IgG umane attraversano la barriera placentare; pertanto, tildrakizumab può essere trasferito dalla madre al feto.
- Un embrione fetale evolutivo Lo studio di tildrakizumab su scimmie gravide non ha rivelato alcun effetto correlato al trattamento su sviluppando feto quando è stato somministrato tildrakizumab per via sottocutanea durante organogenesi (Organo sviluppo) di Nascita (consegna) a dosi fino a 159 volte la dose massima raccomandata per l'uomo.
- Consulta le nostre pagine sulla sicurezza dei medicinali assunti durante la gravidanza e sui prodotti biologici e innovativi molecola trattamenti, riproduzione e psoriasi.
Donne che allattano
- Non ci sono informazioni sulla presenza di tildrakizumab nel latte materno o sui suoi effetti sul lattante.
- Quando si prescrive tildrakizumab alla madre deve essere preso in considerazione il potenziale rischio-beneficio.
- Vedi la nostra pagina sull'allattamento al seno e sulla pelle.
Bambini
La sicurezza e l'efficacia di tildrakizumab nei bambini di età inferiore a 18 anni non sono state valutate.
Anziani
Gli studi clinici con tildrakizumab non hanno incluso un numero sufficiente di persone di età pari o superiore a 65 anni per determinare se rispondono in modo diverso rispetto ai soggetti più giovani.
Pazienti con epatica o renale disabilità
Non sono stati effettuati studi per valutare l'effetto della compromissione epatica o renale su farmacocinetica di tildrakizumab.
Quali sono i rischi di tildrakizumab?
Eventi avversi con tildrakizumab
Il più comune Reazioni avverse tildrakizumab riportati sono:
- Vie respiratorie superiori infezioni (in> 10% dei pazienti)
- Reazioni al sito di iniezione (3%)
- Diarrea (2%).
Quali sono le interazioni farmacologiche avverse di tildrakizumab?
Citocromo P450 (CYP) substrati
Nei soggetti con psoriasi a placche, l'area sotto la curva concentrazione-tempo (AUC∞) destrometorfano (CYP2D6 substrato) è aumentato di 20% durante l'utilizzo contemporaneamente con tildrakizumab 200 mg (due volte la dose raccomandata approvata).
Nessun cambiamento clinicamente significativo dell'AUC∞ Sono stati osservati caffeina (substrato del CYP1A2), warfarin (substrato del CYP2C9), omeprazolo (substrato del CYP2C19) o midazolam (substrato del CYP3A4) quando somministrati contemporaneamente a tildrakizumab.
Non sono disponibili dati sulla capacità dei vaccini vivi o inattivati di suscitare una risposta immunitaria nei pazienti in trattamento con tildrakizumab. I vaccini vivi non devono essere usati contemporaneamente durante il trattamento con tildrakizumab.
Controindicazioni a tildrakizumab
Tildrakizumab è controindicato in soggetti che:
- Avere precedenti seri ipersensibilità reazioni a tildrakizumab o ad uno qualsiasi dei eccipienti nel prodotto
- Avere un'infezione in corso persistente o ricorrente
- Hai la tubercolosi o sei stato a stretto contatto con qualcuno affetto da tubercolosi.
- Ricevuto di recente o in programma per ricevere una vaccinazione
- Stai pianificando una gravidanza
- Stai attualmente allattando al seno o stai pianificando di allattare.
Outlook Quali sono le prospettive per il trattamento con tildrakizumab?
La neutralizzazione selettiva di IL-23 è una strategia vantaggiosa per il trattamento della psoriasi. I dati preliminari degli studi di fase II e III hanno dimostrato la capacità di questo terapeutico classe per indurre la clearance completa o quasi completa della psoriasi in molti pazienti.
Gli attuali farmaci biologici con un meccanismo simile a tildrakizumab includono ustekinumab, che è un antagonista di IL-12 e -23, e guselkumab, che è un altro bloccante di IL-23.
Dato l'obiettivo terapeutico, un programma di somministrazione sottocutanea prolungato di 12 settimane e un profilo di sicurezza ed efficacia paragonabile a ustekinumab, si prevede che tildrakizumab possa essere somministrato insieme a guselkumab come trattamento preferenziale per la psoriasi.
Il periodo di somministrazione di 12 settimane di tildrakizumab può essere più conveniente del programma di mantenimento di 8 settimane di guselkumab.
Finora non ci sono studi di confronto diretto tra tildrakizumab e guselkumab.
Sulla base dei risultati fino ad oggi, il tildrakizumab sembra essere un'opzione terapeutica promettente per la psoriasi a placche da moderata a grave, sebbene siano necessari ulteriori studi per valutarne la sicurezza e l'efficacia a lungo termine.