Introducción
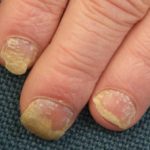
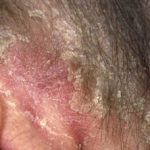
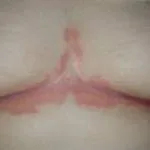
En marzo de 2018, el tratamiento biológico tildrakizumab (Ilumya ™; Sun Pharma India) recibió la aprobación de la Administración de Drogas y Alimentos de EE. UU. (FDA) para el tratamiento de enfermedades moderadas a graves. placa psoriasis en pacientes candidatos a sistémico terapia o fototerapia. Sun Pharma obtuvo la licencia monoclonal anticuerpo (un fármaco biológico), que se une selectivamente a la subunidad p19 de interleucina 23 (IL-23) e inhibe su interacción con la IL-23 receptor, de Merck and Co. (Nueva Jersey, EE. UU.) en 2014.
La aprobación de la FDA se basó en la seguridad y eficacia datos de los ensayos clínicos de fase III de reSURFACE, que relacionaron tildrakizumab con mejoras significativas tanto en el área de psoriasis como en el índice de gravedad (PASI) y la Evaluación Global del Médico (PGA) en la Semana 12, en comparación con placebo.
Consulte nuestra página sobre evidencia clave de ensayos clínicos para tildrakizumab.
Almirall tiene derechos sobre desarrollar y comercializar la droga en Europa. Actualmente, la Agencia Europea de Medicamentos está revisando una solicitud que busca la aprobación del medicamento en Europa. Tildrakizumab no está disponible actualmente en Nueva Zelanda (2018).
¿Cómo actúa tildrakizumab?
Tildrakizumab es un monoclonal humano inmunoglobulina Anticuerpo G1 lambda (IgG1λ) que se une selectivamente a la subunidad p19 de IL-23 e inhibe su interacción con el receptor de IL-23.
IL-23 promueve la normalidad inflamatorio y respuestas inmunes. Psoriasis y otros autoinmune Las enfermedades inflamatorias de la piel son el resultado de la sobreexpresión de las subunidades p19 y p40 de IL-23. Tildrakizumab se une selectivamente a la subunidad p19 de IL-23 en células dendríticas y queratinocitos, bloqueando su interacción con los receptores de IL-23 y previniendo la liberación de proinflamatorios citocinas y quimiocinas.
Tildrakizumab bloquea así la señalización anormalmente intensificada de las cascadas inflamatorias (el efecto de reacción en cadena que inicia la respuesta inflamatoria) que promueven hiperproliferación (altas tasas de división celular) de queratinocitos y la formación de psoriásicos placas.
¿Cómo se administra tildrakizumab?
Tildrakizumab debe administrarse subcutáneo inyección bajo la guía y supervisión de un médico. La dosis recomendada es de 100 mg en la semana 0 y la semana 4, y posteriormente cada 12 semanas.
El tratamiento con tildrakizumab no debe iniciarse en pacientes con algún activo clínicamente importante. infección hasta que la infección se resuelva o se trate adecuadamente. La dosis olvidada debe inyectarse tan pronto como se recuerde, y la siguiente dosis debe tomarse a la hora programada adecuada.
Tildrakizumab no debe inyectarse en áreas donde la piel esté sensible, amoratada, enrojecida, dura, gruesa, escamoso, o afectados por psoriasis, ya que puede aumentar el riesgo de infección.
Evaluación previa al tratamiento de tuberculosis e inmunización
Los pacientes que están siendo evaluados para el tratamiento con tildrakizumab deben someterse a un examen de detección de tuberculosis y se debe revisar su estado de vacunación. Vea nuestra página sobre inmunización en inmunosuprimido dermatología pacientes.
- Pacientes cuya detección de tuberculosis sea positiva o que tengan antecedentes de latente tuberculosis debe tratarse adecuadamente antes de la administración de tildrakizumab, porque el fármaco puede reactivar la tuberculosis.
- Los pacientes no deben ser inmunizados con vacunas vivas durante el tratamiento con tildrakizumab.
El uso de tildrakizumab en poblaciones específicas
Mujeres embarazadas
- Los datos limitados disponibles sobre el uso de tildrakizumab en mujeres embarazadas no indican un riesgo asociado al fármaco de defectos de nacimiento importantes y aborto espontáneo.
- Se sabe que la IgG humana atraviesa la barrera placentaria; por lo tanto, tildrakizumab puede transferirse de la madre al feto.
- Un embriofetal de desarrollo El estudio realizado con tildrakizumab en monas preñadas no reveló efectos relacionados con el tratamiento en la desarrollando feto cuando se administró tildrakizumab subcutáneamente durante organogénesis (Organo desarrollo) a cerca parto (parto) en dosis de hasta 159 veces la dosis máxima recomendada en humanos.
- Consulte nuestras páginas sobre la seguridad de los medicamentos que se toman durante el embarazo y sobre productos biológicos y novedosos molécula tratamientos, reproducción y psoriasis.
Las mujeres en período de lactancia
- No hay información sobre la presencia de tildrakizumab en la leche materna o sus efectos en el lactante.
- Se debe considerar el potencial riesgo-beneficio al prescribir tildrakizumab a la madre.
- Vea nuestra página sobre lactancia y piel.
Niños
No se ha evaluado la seguridad y eficacia de tildrakizumab en niños menores de 18 años.
Personas mayores
Los estudios clínicos con tildrakizumab no incluyeron un número suficiente de personas de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes.
Pacientes con hepático o renal discapacidad
No se han realizado ensayos para evaluar el efecto de la insuficiencia hepática o renal en la farmacocinética de tildrakizumab.
¿Cuáles son los riesgos de tildrakizumab?
Eventos adversos con tildrakizumab
Los más comunes Reacciones adversas informados de tildrakizumab son:
- Respiratorio superior infecciones (en> 10% de los pacientes)
- Reacciones en el lugar de la inyección (3%)
- Diarrea (2%).
¿Cuáles son las interacciones farmacológicas adversas del tildrakizumab?
Citocromo P450 (CYP) sustratos
En sujetos con psoriasis en placas, el área bajo la curva de tiempo de concentración (AUC∞) de dextrometorfano (CYP2D6 sustrato) aumentado en un 20% cuando se usa concomitantemente con tildrakizumab 200 mg (el doble de la dosis recomendada aprobada).
Sin cambios clínicamente significativos en el AUC∞ Se han observado casos de cafeína (sustrato de CYP1A2), warfarina (sustrato de CYP2C9), omeprazol (sustrato de CYP2C19) o midazolam (sustrato de CYP3A4) cuando se administran al mismo tiempo que tildrakizumab.
No se dispone de datos sobre la capacidad de las vacunas vivas o inactivas para provocar una respuesta inmunitaria en pacientes que reciben tratamiento con tildrakizumab. No se deben utilizar vacunas vivas de forma concomitante durante el tratamiento con tildrakizumab.
Contraindicaciones a tildrakizumab
Tildrakizumab es contraindicado en individuos que:
- Tener previas graves hipersensibilidad reacciones a tildrakizumab oa cualquiera de los excipientes en el producto
- Tiene una infección actual persistente o recurrente
- Tiene tuberculosis o ha estado en contacto cercano con alguien con tuberculosis.
- Recibió recientemente o está programado para recibir una vacuna
- Planea quedar embarazada
- Está amamantando actualmente o planea hacerlo.
Outlook ¿Cuál es la perspectiva del tratamiento con tildrakizumab?
La neutralización selectiva de IL-23 es una estrategia ventajosa para tratar la psoriasis. Los datos preliminares de los ensayos de fase II y III han demostrado la capacidad de este terapéutico clase para inducir el aclaramiento completo o el aclaramiento casi completo de la psoriasis en muchos pacientes.
Los fármacos biológicos actuales con un mecanismo similar al tildrakizumab incluyen ustekinumab, que es un antagonista de IL-12 y -23, y guselkumab, que es otro bloqueador de IL-23.
Dado el objetivo terapéutico, una pauta de administración subcutánea prolongada de 12 semanas y un perfil de seguridad y eficacia comparable a ustekinumab, se prevé que tildrakizumab se puede administrar junto con guselkumab como tratamiento preferencial para la psoriasis.
El período de administración de 12 semanas de tildrakizumab puede ser más conveniente que el programa de mantenimiento de 8 semanas de guselkumab.
Hasta ahora no hay estudios de comparación directa entre tildrakizumab y guselkumab.
Según los resultados obtenidos hasta la fecha, tildrakizumab parece ser una opción terapéutica prometedora para la psoriasis en placa de moderada a grave, aunque se necesitan más estudios para evaluar su seguridad y eficacia a largo plazo.