Che cos'è ereditario angioedema?
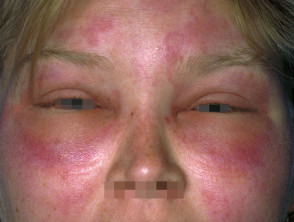
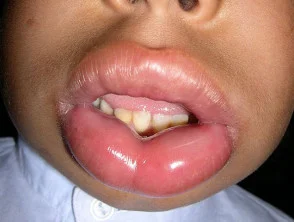
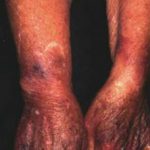
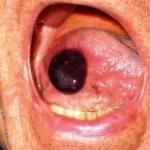
L’angioedema ereditario è raro, autosomica malattia dominante associata a una carenza o disfunzione di C1-esterasi-inibitore (C1-INH). L'angioedema ereditario provoca spontaneità, ricorrentee gonfiore potenzialmente letale in diverse regioni del corpo, incluso il laringe.
Angioedema
Cos’è lanadelumab?
lanadelumab (chiamato anche lanadelumab-flyo) è un trattamento biologico su prescrizione utilizzato in pazienti di età pari o superiore a 12 anni per prevenire gravi attacchi di gonfiore dovuti ad angioedema ereditario. È il primo monoclonale anticorpo disponibile per angioedema ereditario.
Lanadelumab è stato approvato dalla Food and Drug Administration (FDA) statunitense nell’agosto 2018, in Canada nel settembre 2018 e dalla Commissione Europea nel novembre 2018. Le domande di regolamentazione per lanadelumab sono allo studio anche in Australia. lanadelumab non è attualmente disponibile in Nuova Zelanda.
Lanadelumab è commercializzato con il marchio Takhzyro™ da Dyax Corp (una filiale di Shire) con sede a Burlington, MA, USA.
Come funziona lanadelumab?
lanadelumab è completamente umano immunoglobuline G1, anticorpo monoclonale a catena leggera kappa che fornisce inibizione di plasma callicreina, un regolatore critico degli attacchi di angioedema ereditario.
- L'attività della callicreina plasmatica è regolata dall'attività C1-INH.
- La carenza o la disfunzione di C1-INH porta ad aumenti incontrollati dell'attività della callicreina plasmatica.
- La callicreina plasmatica è a proteasi che funziona dividendo la parte superiore molecolare peso del chininogeno (a coagulazione proteina) per generare il pro-infiammatorio peptide bradichinina. La bradichinina è un potente vasodilatatore e aumenta vascolare permeabilità, che è la causa del gonfiore e del dolore associati all'angioedema ereditario.
- Lanadelumab blocca il proteolitico sito attivo della callicreina plasmatica, prevenendo la scissione del chininogeno in bradichinina.
- Lanadelumab, pertanto, riduce l’attività della callicreina e della bradichinina plasmatiche nei pazienti con angioedema ereditario.
Qual è l'indicazione per lanadelumab?
Lanadelumab è indicato per prevenire attacchi ricorrenti di angioedema ereditario in pazienti di età pari o superiore a 12 anni.
- Non è destinato al trattamento di acuto attacchi di angioedema ereditario.
- Il trattamento deve essere iniziato sotto la supervisione di un medico esperto nel trattamento di pazienti affetti da angioedema ereditario.
Come viene somministrato lanadelumab?
Lanadelumab può essere autosomministrato dal paziente o somministrato da un caregiver dopo aver ricevuto la formazione in merito sottocutaneo tecnica di iniezione da parte di un operatore sanitario.
- La dose iniziale raccomandata è 300 mg di lanadelumab mediante iniezione sottocutanea ogni 2 settimane.
- L'iniezione deve essere limitata ai siti di iniezione raccomandati (addome, cosce e parte esterna della parte superiore delle braccia), ruotando il sito di iniezione secondo necessità.
- Nei pazienti che non manifestano attacchi di gonfiore durante il trattamento, la dose può essere ridotta a 300 mg ogni 4 settimane.
- Se si dimentica una dose di lanadelumab, la dose dimenticata deve essere somministrata il prima possibile, garantendo un intervallo di almeno 10 giorni tra le dosi.
Controindicazioni a lanadelumab
Il principale controindicazione lanadelumab lo è ipersensibilità al Sostanza attiva o a uno qualsiasi dei file eccipienti.
Avvertenze e precauzioni
tracciabilità
Per migliorare la tracciabilità dei medicinali biologici, il nome e il numero di lotto del lanadelumab somministrato devono essere chiaramente registrati.
Reazioni ipersensibili
Sono state osservate reazioni di ipersensibilità a lanadelumab. In caso di reazione di ipersensibilità grave, lanadelumab deve essere interrotto immediatamente e deve essere iniziato un trattamento appropriato.
generale
Lanadelumab non è indicato per il trattamento degli attacchi acuti di angioedema ereditario. In caso di angioedema recidivo, deve essere iniziato un trattamento personalizzato con farmaci di salvataggio approvati.
Non sono disponibili dati clinici sull’uso di lanadelumab in pazienti con angioedema ereditario con attività C1-INH normale.
Modifica della dose
Pazienti con renale disabilità
Non sono stati condotti studi in pazienti che assumevano lanadelumab e presentavano grave insufficienza renale. Non si prevede che la compromissione renale influisca sull’esposizione a lanadelumab o sul suo profilo di sicurezza. Non è richiesto alcun aggiustamento della dose nei pazienti con insufficienza renale.
Pazienti con epatica disabilità
Non è richiesto alcun aggiustamento della dose nei pazienti che assumono lanadelumab e che presentano compromissione epatica. Non si prevede che la compromissione epatica influenzi l’esposizione a lanadelumab. Non sono disponibili studi su pazienti con compromissione epatica moderata o grave.
Anziani
Non è richiesto alcun aggiustamento della dose per i pazienti di età superiore a 65 anni poiché non si prevede che l’età influisca sull’esposizione a lanadelumab.
Bambini
Sicurezza e efficacia di lanadelumab nei bambini di età inferiore a 12 anni non è stato stabilito. Nessun dato disponibile.
Uso di lanadelumab in popolazioni specifiche
Donne incinte
Non sono disponibili dati sull’uso di lanadelumab nelle donne in gravidanza per informare sui rischi associati al farmaco. Monoclonale anticorpi poiché lanadelumab può attraversare la placenta durante il terzo trimestre di gravidanza con effetti potenzialmente dannosi sul feto. Studi su lanadelumab nelle donne in gravidanza scimmie cynomolgus, trattato a 33 volte la dose umana massima raccomandata, non ha rivelato alcuna prova di danno al sviluppando feto.
Madri che allattano
Non è noto se lanadelumab o il suo metaboliti Sono escreti nel latte materno. Poiché molti farmaci vengono escreti nel latte materno, le madri devono interrompere l’allattamento al seno prima di usare lanadelumab. Disponibile farmacocinetica I dati nelle scimmie cynomolgus hanno dimostrato che l’escrezione di lanadelumab nel latte è pari a circa 0,2% del livello plasmatico materno.
Bambini
La sicurezza e l’efficacia di lanadelumab nei bambini di età inferiore a 12 anni non sono state stabilite.
Anziani
Negli studi clinici non sono state osservate differenze complessive in termini di sicurezza o efficacia tra i pazienti di età superiore a 65 anni e i pazienti più giovani trattati con lanadelumab.
Individui in età fertile
L’effetto di lanadelumab sulla fertilità non è stato valutato nell’uomo. Lanadelumab non ha avuto effetti sulla fertilità maschile o femminile nelle scimmie cynomolgus.
Quali sono le possibili interazioni farmacologiche con lanadelumab?
Non sono stati condotti studi specifici di interazione farmacologica con lanadelumab. In base alle sue caratteristiche non sono attese interazioni farmacocinetiche con farmaci somministrati in concomitanza.
Interazione con il test aPPT
- Lanadelumab può aumentare il tempo di tromboplastina parziale attivata (aPTT) a causa di un’interazione con il test dell’aPTT.
- Reagenti utilizzati nel test di laboratorio aPTT avviano la coagulazione intrinseca attraverso l'attivazione della callicreina plasmatica nel sistema di attivazione del contatto.
- In questo studio l’inibizione della callicreina plasmatica da parte di lanadelumab può aumentare l’aPTT.
Quali sono i possibili effetti collaterali di lanadelumab?
Gli effetti indesiderati più comuni nei pazienti che hanno ricevuto lanadelumab negli studi clinici sono descritti di seguito.
Effetti collaterali con più di 10% incidenza
Alla dose di lanadelumab 300 mg ogni 2 settimane, quanto segue Reazioni avverse dove vedere:
- Reazioni nel sito di iniezione, incluso dolore, eritemae contusioni (56%)
- Tratto respiratorio superiore infezione (44%)
- Mal di testa (33%)
- Mialgia (11%).
Alla dose di lanadelumab 300 mg ogni 4 settimane sono state osservate le seguenti reazioni avverse:
- Reazioni nel sito di iniezione (45%)
- Infezione del tratto respiratorio superiore (31%)
- Mal di testa (21%).
Effetti collaterali di un'incidenza da 1 a 10%
Le reazioni avverse da 1 a 10% osservate con lanadelumab includono:
- Aumento dell’alanina transferasi (ALT) e aspartato transferasi (AST) fegato enzimi (2%)
- Ipersensibilità (1%): sintomi gravi reazione allergica includere orticaria, prurito/gonfiore (soprattutto del viso, della lingua e della gola), forti capogiri e difficoltà a respirare.
Con una dose di lanadelumab da 300 mg ogni 2 settimane sono state osservate le seguenti reazioni avverse:
- Eruzione (4%)
- Vertigini (4%)
- Diarrea (4%).
Alla dose di lanadelumab 300 mg ogni 4 settimane sono state osservate le seguenti reazioni avverse:
- Eruzione (10%)
- Vertigini (10%).
immunogenicità
Il trattamento con lanadelumab è stato associato a sviluppo di anticorpi anti-farmaco in 10 su 84 pazienti (11,9%). Tutti gli anticorpi Titoli Erano brevi. La risposta anticorpale anti-farmaco è stata transitorio nel 20% di soggetti positivi agli anticorpi antifarmaco; due degli 84 pazienti trattati con lanadelumab (2.4%) sono risultati positivi agli anticorpi neutralizzanti.
Lo sviluppo di anticorpi antifarmaco, inclusi anticorpi neutralizzanti contro lanadelumab, non sembra influenzare negativamente la farmacocinetica e farmacodinamico profili o risposta clinica.