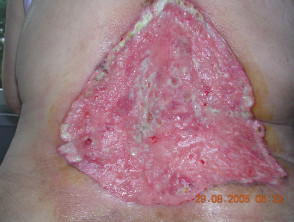
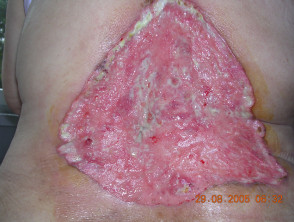
Avanzado basal célula carcinoma
El carcinoma de células basales (BCC) generalmente es curable si el lesiones están restringidos a un área pequeña de la piel. Sin embargo, en casos raros, las lesiones pueden desfigurar, invadir el tejido circundante o metástasis. En estos casos de BCC avanzado, la enfermedad no se puede tratar de manera eficaz con los tratamientos estándar de cirugía o radiación.
¿Qué es vismodegib?
El 30 de enero de 2012, la Administración de Drogas y Alimentos de los EE. UU. (FDA) aprobó vismodegib (Erivedge®, fabricado por Genentech, Inc. EE. UU.) Para el tratamiento de adultos con metastásico carcinoma de células basales. Actualmente no está financiado por PHARMAC en Nueva Zelanda (agosto de 2016).
Vismodegib está indicado para su uso en pacientes adultos con células basales localmente avanzadas. cáncer que no son candidatos para cirugía o radiación y pacientes cuyo cáncer ha hecho metástasis.
Este es el primer medicamento aprobado por la FDA para su uso en formas avanzadas de BCC, uno de los cánceres de piel más comunes.
Carcinoma de células basales avanzado
BCC avanzado
¿Cómo se administra vismodegib?
- Vismodegib se presenta en forma de cápsulas para administración oral.
- La dosis inicial recomendada es de 150 mg por vía oral una vez al día hasta que cese la progresión de la enfermedad o hasta que haya una cantidad inaceptable de toxicidad.
- Si se olvida una dosis de cápsula programada, esa dosis no debe "recuperarse"; reanude la toma de cápsulas con la siguiente dosis programada.
- Vismodegib puede tomarse con o sin alimentos.
- Se aconseja a los pacientes que traguen las cápsulas enteras y que no las trituren ni las abran.
- Las cápsulas deben almacenarse a temperatura ambiente entre 68 ° F y 77 ° F (20 ° C a 25 ° C).
¿Cómo actúa vismodegib?
- Vismodegib es un fármaco administrado por vía oral diseñado para selectivamente inhibir señalización anormal en la vía Hedgehog (Hh), que es un molecular conductor de BCC.
- Vismodegib se une e inhibe Smoothened, una transmembrana proteína involucrado en la transducción de señales Hedgehog.
- La vía Hh promueve celular desarrollo y división en varios tipos de células, tanto por activación celular directa como por activación secundaria de múltiples vías de generación de tejido, incluyendo angiogénesis (nuevo vaso sanguíneo formación) y crecimiento de tejidos.
- La vía de Hh generalmente se sobreactiva en BCC a través de la regulación a la baja de la señal de Hedgehog inhibición.
Enlace a evidencia clave de ensayos clínicos sobre vismodegib
Posibles interacciones farmacológicas con vismodegib
- Sistémico exposición a vismodegib y incidencia de eventos adversos puede aumentar cuando el fármaco se coadministra con claritromicina, eritromicina o azitromicina, antibióticos que inhiben el transportador de salida P-glicoproteína.
- Vismodegib no inhibe ni induce CYP450 enzimas.
- Drogas que alteran el pH del tracto gastrointestinal superior (por ejemplo, bomba de protones inhibidores, H2-receptor antagonistas y antiácidos) pueden alterar la solubilidad de vismodegib y reducir su biodisponibilidad.
- No se ha realizado ningún estudio clínico formal para evaluar el efecto de los agentes que alteran el pH gástrico en la eficacia de vismodegib.
- Vismodegib no interactúa con los anticonceptivos orales.
Eventos adversos asociados con vismodegib
Los más comunes Reacciones adversas (con una incidencia del 10% o más) asociados con vismodegib en ensayos clínicos son:
- espasmos musculares
- cabello pérdida debido a drogas inducidas alopecia
- sensación de sabor alterada
- pérdida de peso
- fatiga
- náusea
- Diarrea
- disminucion del apetito.
El seguimiento Las reacciones adversas a medicamentos se han identificado durante el uso posterior a la aprobación de vismodegib en base a informes de casos y estudios iniciados por investigadores:
- fusión prematura de epífisis (placas de crecimiento)
- Pubertad precoz.
El uso de vismodegib en poblaciones particulares
Mujeres embarazadas
- Vismodegib ha sido aprobado con un recuadro de advertencia que indica que el uso de este medicamento puede provocar la muerte embriofetal o defectos de nacimiento graves cuando se administra durante el embarazo.
- Vismodegib puede causar defectos de nacimiento graves o muerte fetal.
- El estado de embarazo debe verificarse antes de iniciar el tratamiento con vismodegib.
- Se debe realizar una prueba de embarazo en mujeres en edad fértil dentro de los siete días antes de comenzar con vismodegib.
- Las mujeres en edad fértil deben ser advertidas de la necesidad de dos métodos anticonceptivos fiables (incluido un método de barrera) o de la abstinencia total de las relaciones sexuales.
- Para evitar el embarazo, parto altamente efectivo. controlar Se recomienda antes de comenzar con vismodegib, durante el tratamiento y durante 24 meses después de la última dosis del fármaco, debido al potencial de causar graves de desarrollo defectos en lactantes y niños amamantados (nota: este tiempo se extendió desde un período anterior de 7 meses).
- Todos los pacientes masculinos que toman vismodegib, incluso aquellos con una vasectomía previa, deben usar condones con espermicida, durante las relaciones sexuales con parejas femeninas mientras toman vismodegib y durante al menos dos meses después de la última dosis del fármaco.
Madres lactantes
- Existe la posibilidad de que se produzcan reacciones adversas graves con vismodegib en los lactantes.
- Las pacientes que reciben vismodegib no deben amamantar.
Donantes de sangre
- Los pacientes no deben donar sangre o productos sanguíneos mientras reciben vismodegib y durante al menos 24 meses después de la última dosis del fármaco.
Niños
- No se ha establecido la seguridad y eficacia de vismodegib en niños. Vismodegib no está aprobado para pediátrico utilizar.
- Se han notificado casos de fusión prematura de las epífisis (placas de crecimiento) en niños con el uso de vismodegib.
Personas mayores
- Los estudios clínicos de vismodegib no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes o para descartar una mayor frecuencia de eventos adversos.
- No se requiere ajuste de dosis en pacientes ≥ 65 años de edad.
Pacientes con hepático discapacidad
- los farmacocinética, la seguridad y tolerabilidad de vismodegib se evaluaron en pacientes con insuficiencia hepática leve, moderada o grave en un estudio clínico específico, después de múltiples dosis de vismodegib.
- Los resultados no demostraron ningún impacto de la insuficiencia hepática en la farmacocinética de vismodegib.
- No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve, moderada o grave.
Pacientes con renal discapacidad
- Resultados de una población farmacocinético El análisis no demostró ningún impacto de la insuficiencia renal en la farmacocinética de vismodegib.
- No se requiere ajuste de dosis en pacientes con insuficiencia renal.
Efecto de la electrofisiología cardíaca
En un estudio en 60 sujetos sanos, terapéutico Las dosis de vismodegib no tuvieron un efecto significativo sobre el intervalo QTc (una medida del tiempo entre el inicio de la onda Q y el final de la onda T en el ciclo eléctrico del corazón).
Consideraciones futuras para vismodegib
Roche y Genentech están evaluando actualmente vismodegib en un ensayo de fase 2 para pacientes con formas operables de BCC.
Las hojas de datos aprobadas por Nueva Zelanda son la fuente oficial de información para estos medicamentos recetados, incluidos los usos aprobados y la información sobre riesgos. Consulte la hoja de datos individual de Nueva Zelanda en el sitio web de Medsafe.