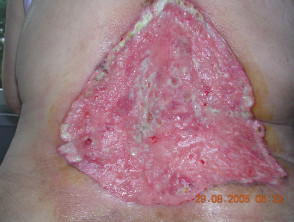
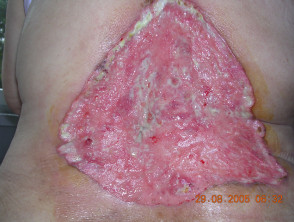
Avanzate basale cellula carcinoma
Il carcinoma basocellulare (BCC) è generalmente curabile se il lesioni sono limitati a una piccola area della pelle. Tuttavia, in rari casi, le lesioni possono sfigurare, invadere i tessuti circostanti o metastasi. In questi casi di BCC avanzato, la malattia non può essere trattata efficacemente con la chirurgia standard o i trattamenti con radiazioni.
Cos'è vismodegib?
Il 30 gennaio 2012, la Food and Drug Administration (FDA) statunitense ha approvato vismodegib (Erivedge®, prodotto da Genentech, Inc. USA) per il trattamento di adulti con metastatico Carcinoma delle cellule basali. Attualmente non è finanziato da PHARMAC in Nuova Zelanda (agosto 2016).
Vismodegib è indicato per l'uso in pazienti adulti con cellule basali localmente avanzate. Cancro che non sono candidati alla chirurgia o alle radiazioni e ai pazienti il cui cancro ha metastatizzato.
Questo è il primo farmaco approvato dalla FDA per l'uso in forme avanzate di BCC, uno dei più comuni tumori della pelle.
Carcinoma basocellulare avanzato
BCC avanzato
Come viene somministrato vismodegib?
- Vismodegib si presenta sotto forma di capsule per somministrazione orale.
- La dose iniziale raccomandata è di 150 mg per via orale una volta al giorno fino a quando la progressione della malattia non si arresta o vi è una quantità inaccettabile di tossicità.
- Se si dimentica una dose di capsula programmata, quella dose non deve "compensare"; riprendere a prendere le capsule con la successiva dose programmata.
- Vismodegib può essere assunto con o senza cibo.
- Si consiglia ai pazienti di ingerire le capsule intere e di non frantumarle o aprirle.
- Le capsule devono essere conservate a temperatura ambiente tra 68 ° F e 77 ° F (20 ° C e 25 ° C).
Come funziona vismodegib?
- Vismodegib è un farmaco somministrato per via orale progettato per selettivamente inibire segnalazione anomala nel percorso Hedgehog (Hh), che è a molecolare Driver BCC.
- Vismodegib si lega e inibisce Smoothened, una membrana transmembrana proteina coinvolto nella trasduzione del segnale Hedgehog.
- Il percorso Hh promuove cellulare sviluppo e divisione in vari tipi di cellule, sia per attivazione cellulare diretta che per attivazione secondaria di molteplici percorsi di generazione di tessuti, inclusi angiogenesi (nuovo vaso sanguigno formazione) e la crescita dei tessuti.
- Il percorso Hh è generalmente iperattivato in BCC attraverso la down-regulation del segnale Hedgehog inibizione.
Collegamento alle prove chiave degli studi clinici su vismodegib
Possibili interazioni farmacologiche con vismodegib
- Sistemico esposizione a vismodegib e incidenza di eventi avversi può aumentare quando il farmaco è co-somministrato con claritromicina, eritromicina o azitromicina, antibiotici che inibiscono il trasportatore di efflusso Pglicoproteina.
- Vismodegib non inibisce né induce CYP450. enzimi.
- Farmaci che alterano il pH tratto gastrointestinale superiore (ad esempio, pompa protonica inibitori, H2-ricevitore antagonisti e antiacidi) possono alterare la solubilità di vismodegib e ridurne la biodisponibilità.
- Non sono stati condotti studi clinici formali per valutare l'effetto di agenti che alterano il pH gastrico su efficacia di vismodegib.
- Vismodegib non interagisce con i contraccettivi orali.
Eventi avversi associati a vismodegib
Il più comune Reazioni avverse (con un'incidenza di 10% o più) associati a vismodegib negli studi clinici sono:
- spasmi muscolari
- capelli perdita dovuta a farmaci indotti alopecia
- sensazione di gusto alterato
- perdita di peso
- fatica
- nausea
- Diarrea
- diminuzione dell'appetito.
Monitoraggio Reazioni avverse ai farmaci sono stati identificati durante l'uso post-approvazione di vismodegib sulla base di segnalazioni di casi e studi avviati dallo sperimentatore:
- fusione prematura delle epifisi (piastre di accrescimento)
- Pubertà precoce.
L'uso di vismodegib in particolari popolazioni
Donne incinte
- Vismodegib è stato approvato con un riquadro di avvertenza in cui si afferma che l'uso di questo farmaco può causare la morte embrio-fetale o gravi difetti alla nascita se somministrato durante la gravidanza.
- Vismodegib può causare gravi difetti alla nascita o morte del feto.
- Lo stato di gravidanza deve essere verificato prima di iniziare il trattamento con vismodegib.
- Un test di gravidanza deve essere eseguito nelle donne in età fertile entro sette giorni prima di iniziare vismodegib.
- Le donne in età fertile devono essere informate della necessità di due metodi contraccettivi affidabili (incluso un metodo di barriera) o dell'astinenza totale dal rapporto sessuale.
- Per evitare la gravidanza, parto altamente efficace. controllo Si raccomanda prima di iniziare vismodegib, durante il trattamento e per 24 mesi dopo l'ultima dose del farmaco, a causa della possibilità di causare gravi evolutivo difetti nei neonati e nei bambini allattati al seno (nota: questo periodo è stato esteso da un periodo precedente di 7 mesi).
- Tutti i pazienti maschi che assumono vismodegib, anche quelli con una precedente vasectomia, devono usare il preservativo con spermicida, durante i rapporti sessuali con le partner femminili durante l'assunzione di vismodegib e per almeno due mesi dopo l'ultima dose del farmaco.
Madri che allattano
- Esiste la possibilità di gravi reazioni avverse con vismodegib nei lattanti.
- I pazienti che ricevono vismodegib non devono allattare.
Donatori di sangue
- I pazienti non devono donare sangue o prodotti sanguigni durante il trattamento con vismodegib e per almeno 24 mesi dopo l'ultima dose del farmaco.
Bambini
- La sicurezza e l'efficacia di vismodegib nei bambini non sono state stabilite. Vismodegib non è approvato per pediatrico uso.
- Sono stati riportati casi di fusione prematura delle epifisi (cartilagini di accrescimento) nei bambini con l'uso di vismodegib.
Anziani
- Gli studi clinici su vismodegib non includevano un numero sufficiente di pazienti di età pari o superiore a 65 anni per determinare se rispondessero in modo diverso ai pazienti più giovani o per escludere una maggiore frequenza di eventi avversi.
- Non è richiesto alcun aggiustamento della dose nei pazienti di età ≥ 65 anni.
Pazienti con epatica disabilità
- il farmacocinetica, la sicurezza e la tollerabilità di vismodegib sono state valutate in pazienti con insufficienza epatica lieve, moderata o grave in uno specifico studio clinico, dopo dosi multiple di vismodegib.
- I risultati non hanno dimostrato alcun impatto della compromissione epatica sulla farmacocinetica di vismodegib.
- Non è richiesto alcun aggiustamento della dose nei pazienti con insufficienza epatica lieve, moderata o grave.
Pazienti con renale disabilità
- Risultati di una popolazione farmacocinetica L'analisi non ha dimostrato alcun impatto dell'insufficienza renale sulla farmacocinetica di vismodegib.
- Non è richiesto alcun aggiustamento della dose nei pazienti con insufficienza renale.
Effetto dell'elettrofisiologia cardiaca
In uno studio su 60 soggetti sani, terapeutico Le dosi di Vismodegib non hanno avuto un effetto significativo sull'intervallo QTc (una misura del tempo tra l'inizio dell'onda Q e la fine dell'onda T nel ciclo elettrico del cuore).
Considerazioni future per vismodegib
Roche e Genentech stanno attualmente valutando vismodegib in uno studio di fase 2 per pazienti con forme operabili di BCC.
Le schede informative approvate dalla Nuova Zelanda sono la fonte ufficiale di informazioni per questi farmaci da prescrizione, inclusi gli usi approvati e le informazioni sui rischi. Vedere la scheda tecnica individuale della Nuova Zelanda sul sito Web di Medsafe.