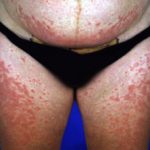
Wat is bexaroteen?
Bexarotene is een geneesmiddel dat voornamelijk wordt gebruikt om te behandelen huid T-cel lymfoom (CTCL). Het is niet beschikbaar in Nieuw-Zeeland.
Indicaties voor behandeling met bexaroteen.
Bexarotene (Targretin®; Ligand Pharmaceuticals Inc., San Diego, CA, VS) is een lid van een subklasse van retinoïden genaamd rexinoïden die selectief activeren retinoïde X-receptoren (RXR), die een andere biologische activiteit hebben dan Retinezuur receptoren (RAR). Bexaroteen en bexaroteen-capsules gel worden gebruikt voor de behandeling van:
- Cutaan T-cellymfoom (CTCL) in een vroeg stadium bij patiënten met hardnekkig of aanhoudend ziekte na andere therapieën of die andere therapieën niet verdragen (gel).
- CTCL in een gevorderd stadium ongevoelig voor ten minste één orale therapie.
- kaposi sarcoom
Werkingsmechanisme van bexaroteen
Bexaroteen bindt zich aan en activeert RXR's die functioneren als ligand-gated transcriptie factoren die controleren gen uitdrukking. Dit leidt tot de modulatie van celgroei, apoptoseY differentiatie. Bexaroteen remt de groei in vitro van sommige tumor hematopoëtische (bloed) cellijnen en geschubd cellulaire oorsprong (huid). Het induceert ook tumor regressie in vivo in sommige diermodellen. Het exacte werkingsmechanisme van bexaroteen bij de behandeling van cutaan T-cellymfoom (CTCL) is niet bekend.
Bexaroteen-farmacologie
- Halfwaardetijd: 7 uur
- Bek plasma tijd: 2 uur
- Eiwit-bevrijd:> 99%
- Metabolisme: door CYP3A4 enzymen
- metabolieten: 6- en 7-hydroxybexaroteen, 6- en 7-oxo-bexaroteen
- uitscheiding: gal
Dosering en toediening van bexaroteen
bexaroteen capsules
Elke zachte gelatinecapsule voor orale toediening bevat 75 mg bexaroteen. De aanbevolen startdosering is 300 mg/m22/dag.
- Bexaroteen-capsules moeten als een enkele dagelijkse dosis via de mond bij een maaltijd worden ingenomen vanwege de veiligheid en effectiviteit gegevens zijn gebaseerd op toediening met voedsel.
- Richtlijnen voor dosisaanpassing: 300 mg/m22/ dag kan het dosisniveau van bexaroteen capsules worden aangepast tot 200 mg / m22/ dag dan 100 mg / m2/ dag, of tijdelijk opgeschort, indien nodig toxiciteit.
- Als er geen tumorrespons is na 8 weken behandeling en als de aanvangsdosis van 300 mg/m2/ dag wordt goed verdragen, de dosis kan worden verhoogd tot 400 mg / m22/ dag met zorgvuldige monitoring.
- Duur van de behandeling: In klinische studies bij CTCL werden bexaroteencapsules gedurende maximaal 97 weken toegediend.
- De behandeling moet worden voortgezet zolang de patiënt er baat bij heeft.
Bexaroteengel 1%
- Huidig: Bexarotene-gel wordt gewoonlijk gedurende de eerste week eenmaal om de dag op de getroffen gebieden aangebracht, daarna met tussenpozen van een week verhoogd tot eenmaal per dag, daarna tweemaal per dag, daarna 3 keer per dag en ten slotte 4 keer per dag.
- Alleen op de huid gebruiken. Bexaroteen-gel mag niet worden aangebracht slijm- membranen zoals ogen, neus, mond, lippen, vagina, het topje van de penis, Rechtsafof jaar. Vermijd het aanbrengen op gezonde delen van de huid omdat irritatie of roodheid kan optreden.
- Voor en na het gebruik van bexaroteengel moeten de handen onmiddellijk met water en zeep worden gewassen. Bedek het aangetaste huidgebied met een royale laag gel. Laat de gel 5-10 minuten drogen voordat u het gebied met kleding bedekt.
- Het behandelde gebied mag niet worden bedekt, verbonden of ingepakt. Wacht ten minste 20 minuten na het douchen of baden voordat u bexaroteen actueel aanbrengt. Gebruik een milde zeep bij het wassen van je huid om irritatie te verminderen. Vermijd douchen, baden of zwemmen gedurende ten minste 3 uur na het aanbrengen van bexaroteengel.
Bexaroteen monitoring
- Bexaroteen-capsules induceren belangrijk lipide afwijkingen bij de meeste patiënten (verhoogde niveaus van bloedvetten). Deze moeten tijdens langdurige therapie worden gecontroleerd en behandeld. Nuchtere bloedlipidenbepalingen moeten worden uitgevoerd voorafgaand aan de start van de behandeling en wekelijks totdat de lipidenrespons op bexaroteencapsules is vastgesteld, wat gewoonlijk binnen 2 tot 4 weken gebeurt, en daarna met tussenpozen van 8 weken. Snel triglyceriden het moet normaal zijn of normaliseren met passende interventie voordat orale behandeling met bexaroteen wordt gestart. Je moet proberen te behouden triglyceriden niveaus onder 400 mg/dL om het risico van te verminderen pancreatitis. Bij personen met een hoog risico moet worden overwogen om een lipidenverlagende medicatie te starten voorafgaand aan de behandeling met bexaroteen.
- Als nuchtere triglyceriden toenemen tijdens de behandeling met bexaroteen, moet een lipidenverlagend medicijn worden gestart en, indien nodig, de dosis bexaroteencapsules worden verlaagd of stopgezet. Vanwege een mogelijke geneesmiddelinteractie wordt het gebruik van gemfibrozil met bexaroteen-capsules niet aanbevolen. In plaats daarvan wordt atorvastatine aanbevolen.
- Patiënten met CTCL die risicofactoren hebben voor pancreatitis (eerdere, ongecontroleerde pancreatitis hyperlipidemie, overmatig alcoholgebruik, ongecontroleerde diabetes mellitus, gal gastro-intestinale aandoeningen en geneesmiddelen waarvan bekend is dat ze de triglyceridenspiegels verhogen of geassocieerd zijn met pancreastoxiciteit) dienen over het algemeen niet te worden behandeld met bexaroteencapsules.
- Bij patiënten met CTCL die een startdosis van 300 mg/m krijgen2/dag oraal bexaroteen, zijn verhogingen van de leverfunctietesten (LFT's) waargenomen. Baseren LFT's moeten worden verkregen en zorgvuldig worden gecontroleerd één, twee en vier weken na aanvang van de behandeling en, indien stabiel, daarna ten minste elke acht weken tijdens de behandeling. Het staken of onderbreken van de behandeling moet worden overwogen als de testresultaten meer dan driemaal de bovengrens van de normale waarden voor SGOT/AST, SGPT /ALTof bilirubine.
- Bexaroteen-capsules leveren biochemisch of klinisch bewijs op hypothyreoïdie (traag werkende schildklier) bij ongeveer de helft van alle behandelde patiënten. Baseline-schildklierfunctietesten moeten worden uitgevoerd en patiënten moeten tijdens de behandeling worden gecontroleerd.
- Het aantal witte bloedcellen (WBC) moet worden bepaald bij aanvang en periodiek tijdens de behandeling. leukopenie (verminderde leukocyten) bij ongeveer 43% van patiënten die een startdosis van meer dan 300 mg/m2 kregen2/ dag oraal bexaroteen.
- Patiënten die worden behandeld met bexaroteen-capsules en die visuele problemen ervaren, moeten een passend oftalmologisch onderzoek ondergaan.
lichtgevoeligheid
Retinoïden als klasse zijn in verband gebracht met lichtgevoeligheid. Mild fototoxiciteit die zich manifesteert als zonnebrand en gevoeligheid van de huid voor zonlicht is waargenomen bij patiënten die worden blootgesteld aan direct zonlicht terwijl ze oraal bexaroteen kregen. Patiënten moeten worden geadviseerd om blootstelling aan zonlicht en kunstmatig ultraviolet licht (inclusief fototherapie en solaria) tot een minimum te beperken tijdens de behandeling met bexaroteen.
Bijwerkingen vanwege bexaroteen
De veiligheid van bexaroteen-capsules is geëvalueerd in klinische onderzoeken. De meest voorkomende bijwerkingen gemeld met a incidentie van ten minste 10% bij CTCL-patiënten die werden behandeld met een startdosis van 300 mg/m22/ dag zijn:
- lipidenafwijkingen (verhoogde triglyceriden, verhoogd LDL en totaal cholesterol en verlaging van HDL-cholesterol)
- hypothyreoïdie
- Hoofdpijn
- zwakheid
- uitslag
- leukopenie, Bloedarmoede (laag aantal witte bloedcellen en hemoglobine)
- misselijkheid
- infectie
- perifere oedeem (gezwollen enkels), buikpijn en een droge huid.
Bijwerkingen gemeld met topisch bexaroteen (incidentie > 10%) zijn onder meer:
- Uitbarsting (72%)
- pruritus / jeuk (36%)
- Pijn (30%)
- Infectie (18%)
- Contact dermatitis (14%)
- Hoofdpijn (14%).
Bijwerkingen met actueel bexaroteen met een incidentie van 1 tot 10% zijn onder meer:
- Oedeem / zwelling (10%)
- Hyperlipidemie (10%)
- Zwakte (6%)
- exfoliërend dermatitis (6%)
- Leukopenie (6%), lymfadenopathie (6%), veranderingen in witte bloedcellen (6%)
- Hoest (6%), faryngitis (6%)
- Zweten (6%)
Contra-indicaties naar bexaroteen
- Bexaroteen-capsules zijn gecontra-indiceerd bij patiënten met een bekende overgevoeligheid (allergie) aan bexaroteen of andere componenten van het product.
- Occlusief verbanden mogen niet worden gebruikt met 1% bexaroteengel.
Geneesmiddelinteracties
- Er zijn geen formele onderzoeken uitgevoerd om geneesmiddelinteracties met bexaroteen te evalueren. Gebaseerd op het metabolisme van bexaroteen door cytochroom P450 3A4-enzymen, ketoconazol, itraconazol, erytromycine, gemfibrozil, grapefruitsap en andere remmers van cytochroom P450 3A4 veroorzaakt naar verwachting verhoogde plasmaconcentraties van bexaroteen. Bovendien kunnen rifampicine, fenytoïne, fenobarbital en andere inductoren van cytochroom P450 3A4 de plasmaconcentraties van bexaroteen verlagen.
- Gelijktijdige toediening van bexaroteencapsules en gemfibrozil resulteert in substantiële verhogingen van de plasmaconcentraties van bexaroteen, waarschijnlijk ten minste gedeeltelijk gerelateerd aan cytochroom P450 3A4. remming door gemfibrozil. Onder vergelijkbare omstandigheden worden de bexaroteenconcentraties niet beïnvloed door gelijktijdig toediening met atorvastatine.
Gebruik van bexaroteen in specifieke populaties
Zwangerschap: Categorie X
- Bexarotene-capsules kunnen schade toebrengen aan de foetus wanneer ze worden toegediend aan een zwangere vrouw en de behandeling mag niet worden toegediend aan een zwangere vrouw of een vrouw die van plan is zwanger te worden. Als een vrouw zwanger wordt terwijl ze oraal bexaroteen gebruikt, moet de behandeling onmiddellijk worden gestaakt en moet de vrouw passend advies krijgen. Vrouwen die zwanger kunnen worden, moeten worden gewaarschuwd om te voorkomen dat ze zwanger worden wanneer ze bexaroteen-capsules gebruiken. Een negatieve zwangerschapstest (bijv. serum Bèta-humaan choriongonadotrofine, bèta-HCG) met een gevoeligheid van ten minste 50 mlU/L moet binnen een week voorafgaand aan de orale therapie worden verkregen en de zwangerschapstest moet maandelijks worden herhaald terwijl de patiënt onder behandeling blijft.
- Mannelijke patiënten met seksuele partners die zwanger zijn, mogelijk zwanger zijn of zwanger kunnen worden, moeten condooms gebruiken tijdens geslachtsgemeenschap tijdens het gebruik van bexaroteen-capsules en gedurende ten minste één maand na de laatste dosis van de medicatie. De therapie moet worden gestart op de tweede of derde dag van een normale menstruatie. Er mag niet meer dan een maand aan capsules aan de patiënt worden gegeven, zodat de resultaten van zwangerschapstesten kunnen worden geëvalueerd en advies over het voorkomen van zwangerschap en geboorteafwijkingen kan worden versterkt.
Gebruik bij zogende moeders
Het is niet bekend of bexaroteen wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk en vanwege het potentieel voor Bijwerkingen bij zuigelingen moet worden besloten of de borstvoeding moet worden gestaakt of dat oraal bexaroteen moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
pediatrisch gebruik
De veiligheid en werkzaamheid bij kinderen zijn niet vastgesteld.
Vitamine A-supplementen
Vanwege de relatie van bexaroteen met vitamine A, moeten patiënten worden geadviseerd om vitamine A-supplementen te beperken tot ≤15.000 IE/dag om mogelijke toevoegingen te vermijden. giftig Effecten.
Patiënten met diabetes mellitus
Voorzichtigheid is geboden bij het toedienen van bexaroteencapsules aan patiënten die dit middel gebruiken insulinemiddelen die de insulinesecretie verhogen (bijvoorbeeld sulfonylureumderivaten) of insulinesensibilisatoren (bijvoorbeeld de thiazolidinedionklasse). Op basis van het werkingsmechanisme zouden bexaroteencapsules de werking van deze middelen kunnen versterken, wat resulteert in: hypoglykemie (lage bloedsuikerspiegel).
nier insufficiëntie
Er zijn geen formele onderzoeken uitgevoerd bij patiënten met nierfalen (nierziekte). Eliminatie via de urine van bexaroteen en de bekende metabolieten ervan is een kleine uitscheidingsroute voor bexaroteen (<1% de la dosis administrada), pero debido a que la insuficiencia renal puede producir cambios significativos en la unión a proteínas y el bexaroteno se une a proteínas> 99%, farmacokinetiek (geneesmiddelconcentraties) kunnen veranderen bij patiënten met nierfalen.
Overdosis bexaroteen
Er zijn geen meldingen van klinische ervaring met een overdosis. Elke overdosis bexaroteencapsules moet worden behandeld met ondersteunende zorg voor de klachten en symptomen van de patiënt.