Invoering
Dabrafenib (TAFINLAR™-capsule) werd in 2013 door de Amerikaanse Food and Drug Administration (FDA) goedgekeurd voor de behandeling van patiënten met inoperabele of metastatisch melanoma met BRAF V600E mutatie gedetecteerd door een door de FDA goedgekeurde test. Gelijktijdig Met deze actie keurde de FDA de THxID BRAF-test (bioMerieux, Inc. VS) goed voor de detectie van BRAF V600E. In november 2015 keurde de FDA ook de combinatie van dabrafenib en trametinib goed voor de behandeling van gemetastaseerd melanoom.
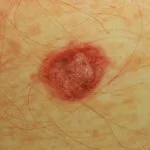
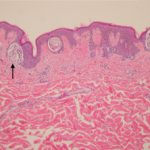
BRAF mutaties komen voor in 50% van melanomen. BRAF remmers als doelwit van dabrafenib mutant BRAF en verbieden de MAPK signaalroute, die de celgroei en overleving bemiddelt. Ze zijn niet effectief bij niet-mutante (wildtype) BRAF-tumoren.
Dabrafenib is niet geïndiceerd voor de behandeling van patiënten met BRAF-wildtype melanoom vanwege het potentiële risico op tumor Promotie.
Hoe werkt dabrafenib?
- Dabrafenib blokkeert een kritieke eiwit molecuul genaamd Mutant B-raf (B-RAF), dat gemuteerd (veranderd) is tot 50% bij melanoompatiënten.
- B-RAF is een eiwit dat deel uitmaakt van de celsignaleringsroute controle S celgroei in verschillende weefsels van het lichaam.
- Mutaties die het B-RAF-eiwit in een actieve toestand vergrendelen, kunnen overmatige signalering in de RAS/RAF/MEK/ ERK-signaleringsroute (MAPK-route), die leidt tot ongecontroleerde groei van melanocyten (pigment cellen).
- Wanneer de activiteit van mutant B-RAF wordt geblokkeerd, kanker De cellen stoppen met groeien en sterven af.
Welke patiënten hebben baat bij behandeling met dabrafenib?
- Dabrafenib is specifiek geïndiceerd voor patiënten met melanoom bij wie de tumoren een gen mutatie genaamd BRAF V600, gedetecteerd door een door de FDA goedgekeurde test.
- Het BRAF-eiwit dat als gevolg van deze genetische mutatie wordt geproduceerd, heeft de aminozuren (eiwitbouwstenen) glutamaat in plaats van het aminozuur valine op positie 600.
- Dabrafenib is niet geïndiceerd voor gebruik bij patiënten zonder de V600-mutatie.
- Dabrafenib heeft activiteit aangetoond bij patiënten met gemetastaseerd melanoom BRAF V600E en BRAF V600K, inclusief patiënten met metastase.
Link naar belangrijk bewijsmateriaal uit klinische onderzoeken
Dosering en administratie
De aanbevolen dosis is tweemaal daags oraal 150 mg, in te nemen minimaal 1 uur vóór of minimaal 2 uur na een maaltijd.
Wat bijwerkingen kan dabrafenib veroorzaken?
In klinische onderzoeken kwamen bijwerkingen vaak voor, maar deze leidden zelden tot dosisverlaging of stopzetting.
De meest voorkomende toxiciteiten (variërend van 15% tot 33%) waren onder meer:
- artralgie (pijnlijke gewrichten)
- hyperkeratose (droog of geschubd bond)
- koortskoorts)
- vermoeidheid
- Hoofdpijn
- misselijkheid
- huid papillomen (goedaardig papels)
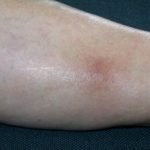
- uitslag (niet-specifieke rode huid)
- wrattig keratose.
Ernstige bijwerkingen omvatten:
- huid geschubd cel carcinomen (9%)
- basaal celcarcinomen (4%)
- hyperglykemie (6%)
- uveïtis en iritis (1%)
de zwangerschap
Dabrafenib kan schade aan de foetus veroorzaken als het wordt toegediend aan een zwangere vrouw (zwangerschapscategorie D). De patiënt moet worden gewaarschuwd voor het potentiële gevaar voor de foetus als dit medicijn tijdens de zwangerschap wordt gebruikt of als de patiënt zwanger wordt terwijl hij dit medicijn gebruikt.
pediatrisch gebruiken
De veiligheid en werkzaamheid van dabrafenib bij kinderen zijn niet vastgesteld.
lever Y nier onbekwaamheid
niet formeel farmacokinetiek Er is een proef uitgevoerd bij patiënten met lever- of nierfalen.
Geneesmiddelinteracties
Dabrafenib wordt voornamelijk via de lever gemetaboliseerd. enzymen CYP2C8 en CYP3A4. Sterke remmers of inductoren van CYP3A4 of CYP2C8 kunnen de concentraties van dabrafenib respectievelijk verhogen of verlagen.
Ja gelijktijdig Het gebruik van sterke remmers (bijv. ketoconazol, nefazodon, claritromycine, gemfibrozil) of sterke inductoren (bijv. rifampicine, fenytoïne, carbamazepine, fenobarbital, sint-janskruid) van CYP3A4 of CYP2C8 is onvermijdelijk; patiënten moeten nauwlettend worden gecontroleerd. Bijwerkingen of verlies van effectiviteit.
Gelijktijdige toediening van dabrafenib met warfarine, dexamethason of hormonale anticonceptiva kan ook leiden tot verlaagde concentraties en verlies van werkzaamheid.
medicijnen die de pH van het bovenste maagdarmkanaal (bijv. protonpompremmers, H2-ontvanger antagonisten, antacida) kunnen de oplosbaarheid van dabrafenib veranderen en de biologische beschikbaarheid ervan verminderen. Er is echter geen formeel klinisch onderzoek uitgevoerd om het effect te evalueren van middelen die de pH in de maag veranderen systemisch absorptie van dabrafenib.
Vermeende verschillen tussen dabrafenib en vemurafenib
Dabrafenib en vemurafenib zijn selectieve BRAF type 1-remmers met bewezen werkzaamheid bij BRAF V600E-gemetastaseerd melanoom. Ze delen veel kenmerken, waaronder klinische activiteit en gedefinieerde klasse toxiciteit; Er zijn echter verschillen tussen medicijnen.
- Dabrafenib is een selectiever medicijn remmer van BRAF V600E dan vemurafenib.
- Dabrafenib is getest intracraniaal activiteit, en gegevens uit fase I- en II-onderzoeken ondersteunen de klinische werkzaamheid ervan bij BRAF V600E- en BRAF V600K-patiënten met hersenmetastasen.
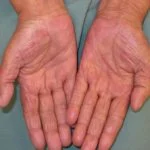
- Huidtoxiciteiten zoals lichtgevoeligheidhuiduitslag, hyperkeratose en huid plaveiselcellen carcinoom Ze komen voor bij beide geneesmiddelen, maar er is gemeld dat ze in mindere mate voorkomen bij dabrafenib.
- Hepatitis lijkt specifiek te zijn voor vemurafenib. Het is in geen enkel onderzoek met dabrafenib gemeld.
Dabrafenib-beperkingen en toekomstige richtingen
Bij patiënten met BRAFmut-gemetastaseerd melanoom zorgt Dabrafenib voor hoge responspercentages en een beter algemeen overlevingspercentage chemotherapie, met een mild en beheersbaar toxiciteitsprofiel. De duur van de uitkering is echter doorgaans kort vanwege de ontwikkelen van verworven weerstand.
Combinatietherapieën die zich richten op meerdere componenten van celsignalering, zoals CombiDT (combinatie van dabrafenib met trametinib [een MEK-remmer vervaardigd door GSK en goedgekeurd door de Amerikaanse FDA]), heeft hogere responspercentages en een langduriger klinisch voordeel laten zien dan monotherapie met dabrafenib. De combinatie van dabrafenib en trametinib, Mekinist™, werd voorlopig goedgekeurd door de FDA inoperabel en gemetastaseerd melanoom met BRAF V600E- of V600K-mutaties, in 2014 met reguliere goedkeuring in november 2015.
Omdat beide geneesmiddelen zich op de MAPK-route richten, kan een gecombineerde blokkade de verworven resistentie omzeilen of vertragen als gevolg van reactivering van de MAPK-route.