Introducción
Dabrafenib (Cápsula TAFINLAR ™) fue aprobado por la Administración de Drogas y Alimentos de los EE. UU. (FDA) en 2013 para el tratamiento de pacientes con enfermedades no operables o metastásico melanoma con BRAF V600E mutación detectado por una prueba aprobada por la FDA. Concurrente con esta acción, la FDA aprobó el ensayo THxID BRAF (bioMerieux, Inc. EE. UU.) para la detección de BRAF V600E. En noviembre de 2015, la FDA también aprobó la combinación de dabrafenib y trametinib para el tratamiento del melanoma metastásico.
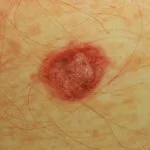
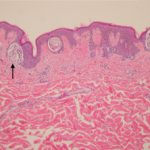
BRAF mutaciones ocurren en el 50% de melanomas. BRAF inhibidores como el objetivo de dabrafenib mutante BRAF y inhibir los MAPK vía de señalización, que media el crecimiento y la supervivencia celular. No son eficaces en tumores BRAF no mutantes (de tipo salvaje).
Dabrafenib no está indicado para el tratamiento de pacientes con melanoma BRAF de tipo salvaje debido al riesgo potencial de tumor promoción.
¿Cómo actúa el dabrafenib?
- Dabrafenib bloquea un crítico proteína molécula llamado Mutant B-raf (B-RAF), que está mutado (cambiado) hasta en el 50% de los pacientes con melanoma.
- B-RAF es una proteína que forma parte de la vía de señalización celular que control S crecimiento celular en varios tejidos diferentes del cuerpo.
- Las mutaciones que bloquean la proteína B-RAF en un estado activo pueden causar una señalización excesiva en el RAS / RAF /MEK/ Vía de señalización ERK (vía MAPK), que conduce a un crecimiento descontrolado de melanocitos (pigmento células).
- Cuando se bloquea la actividad de B-RAF mutante, cáncer las células dejan de crecer y mueren.
¿Qué pacientes se benefician del tratamiento con dabrafenib?
- Dabrafenib está específicamente indicado para pacientes con melanoma cuyos tumores expresan un gene mutación llamada BRAF V600, detectada por una prueba aprobada por la FDA.
- La proteína BRAF producida como resultado de esta mutación genética tiene la aminoácidos (componentes básicos de la proteína) glutamato en lugar del aminoácido valina en la posición 600.
- Dabrafenib no está indicado para su uso en pacientes sin la mutación V600.
- Dabrafenib ha demostrado actividad en pacientes con melanoma metastásico BRAF V600E y BRAF V600K, incluidos aquellos con metástasis.
Enlace a evidencia clave de ensayos clínicos
Dosificación y administración
La dosis recomendada es de 150 mg por vía oral dos veces al día, tomados al menos 1 hora antes o al menos 2 horas después de una comida.
Qué eventos adversos puede causar dabrafenib?
En los ensayos clínicos, los eventos adversos fueron comunes pero rara vez llevaron a una reducción o interrupción de la dosis.
Las toxicidades más frecuentes (que oscilan entre el 15% y el 33%) incluyeron:
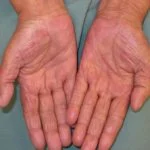
- artralgia (articulaciones dolorosas)
- hiperqueratosis (seco o escamoso piel)
- pirexiafiebre)
- fatiga
- un dolor de cabeza
- náusea
- piel papilomas (benigno pápulas)
- erupción (piel roja inespecífica)
- verrugoso queratosis.
Los eventos adversos graves incluyeron:
- cutáneo escamoso célula carcinomas (9%)
- basal carcinomas de células (4%)
- hiperglucemia (6%)
- uveítis e iritis (1%)
El embarazo
Dabrafenib puede causar daño fetal cuando se administra a una mujer embarazada (categoría D de embarazo). Se debe advertir a la paciente del peligro potencial para el feto si este medicamento se usa durante el embarazo o si la paciente queda embarazada mientras toma este medicamento.
Pediátrico utilizar
No se ha establecido la seguridad y eficacia de dabrafenib en niños.
Hepático y renal discapacidad
No formal farmacocinética Se ha realizado un ensayo en pacientes con insuficiencia hepática o renal.
Interacciones con la drogas
Dabrafenib se metaboliza principalmente por vía hepática. enzimas CYP2C8 y CYP3A4. Los inhibidores o inductores potentes de CYP3A4 o CYP2C8 pueden aumentar o disminuir, respectivamente, las concentraciones de dabrafenib.
Si concomitante El uso de inhibidores potentes (p. ej., ketoconazol, nefazodona, claritromicina, gemfibrozil) o inductores potentes (p. ej., rifampicina, fenitoína, carbamazepina, fenobarbital, hierba de San Juan) de CYP3A4 o CYP2C8 es inevitable, se debe vigilar estrechamente a los pacientes Reacciones adversas o perdida de eficacia.
La coadministración de dabrafenib con warfarina, dexametasona o anticonceptivos hormonales también puede resultar en concentraciones disminuidas y pérdida de eficacia.
Drogas que alteran el pH del tracto gastrointestinal superior (p. ej., inhibidores de la bomba de protones, H2-receptor antagonistas, antiácidos) pueden alterar la solubilidad de dabrafenib y reducir su biodisponibilidad. Sin embargo, no se ha realizado ningún ensayo clínico formal para evaluar el efecto de los agentes que alteran el pH gástrico en la sistémico absorción de dabrafenib.
Supuestas diferencias entre dabrafenib y vemurafenib
Dabrafenib y vemurafenib son inhibidores selectivos de BRAF tipo 1 con eficacia probada en el melanoma metastásico BRAF V600E. Comparten muchos atributos, incluida la actividad clínica y la clase definida toxicidad; sin embargo, existen diferencias entre las drogas.
- Dabrafenib es un medicamento más selectivo inhibidor de BRAF V600E que vemurafenib.
- Dabrafenib ha probado intracraneal actividad, y los datos de los ensayos de fase I y II respaldan su eficacia clínica en pacientes BRAF V600E y BRAF V600K con metástasis cerebrales.
- Toxicidades cutáneas como fotosensibilidad, erupción, hiperqueratosis y cutánea células escamosas carcinoma ocurren con ambos fármacos, pero se ha informado que ocurren en menor grado con dabrafenib.
- Hepatitis parece ser específico de vemurafenib. No se ha informado en ningún ensayo con dabrafenib.
Limitaciones de dabrafenib y direcciones futuras
En pacientes con melanoma metastásico BRAFmut, dabrafenib confiere altas tasas de respuesta y una mejor tasa de supervivencia general quimioterapia, con un perfil de toxicidad leve y manejable. Sin embargo, la duración del beneficio suele ser breve debido a la desarrollo de resistencia adquirida.
Terapias de combinación dirigidas a múltiples componentes de la señalización celular, como CombiDT (combinación de dabrafenib con trametinib [an MEK inhibitor manufactured by GSK and approved by US FDA]), ha mostrado tasas de respuesta más altas y un beneficio clínico más duradero que la monoterapia con dabrafenib. La combinación de dabrafenib y trametinib, Mekinist ™, fue aprobada provisionalmente por la FDA para irresecable y melanoma metastásico con mutaciones BRAF V600E o V600K, en 2014 con aprobación regular en noviembre de 2015.
Como ambos fármacos se dirigen a la vía MAPK, el bloqueo combinado puede eludir o retrasar la resistencia adquirida debido a la reactivación de la vía MAPK.