Invoering
Apremilast (Otezla®; Celgene, New Jersey, VS) is een kleinemolecuul remmer van enzym fosfodiësterase 4, dat een belangrijke rol speelt chronisch ontsteking geassocieerd met psoriasis.
In juli 2019 werd apremilast ook door de FDA goedgekeurd voor de behandeling van de mond. zweren geassocieerd met de ziekte van Behçet.
Waar wordt apremilast voor gebruikt?
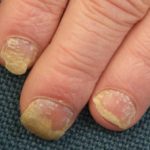
In september 2014 keurde de Amerikaanse Food and Drug Administration (FDA) het gebruik van apremilast goed bij patiënten met nummerplaat psoriasis. Het werd in november 2016 goedgekeurd voor gebruik in Nieuw-Zeeland bij psoriasis.
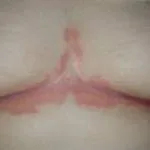
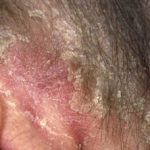
Apremilast werd goedgekeurd voor de behandeling van plaque psoriasis bij patiënten:
- die niet reageerden of intolerant waren voor de behandeling met etanercept (Enbrel®) en adalimumab (Humira®)
- degenen met een geschiedenis van hepatitis B, hepatitis C, demyeliniserende ziekte, maligniteit, chronisch infectie (bijv hiv) of congestief hartfalen
- langdurige patiënten systemisch corticosteroïde therapie.
Het Comité voor geneesmiddelen voor menselijk gebruik (CHMP) van het Europees Geneesmiddelenbureau (EMA) heeft een positief advies uitgebracht voor apremilast voor:
- behandeling van matige tot ernstige chronische plaque psoriasis bij volwassen patiënten die niet reageerden of die een contra-indicatie of als u intolerant bent voor andere systemische therapieën, zoals cyclosporine, methotrexaat of psoraleen, en ultraviolet A (PUVA) licht.
Er is gemeld dat het bijzonder effectief is bij palmoplantair psoriasis.
Van apremilast is ook aangetoond dat het effectief is bij de behandeling van ulceratie bij de ziekte van Behçet.
if (advertentieschermbreedte < 780 ) {
var inline = document.createElement("div");
var ad = document.createElement("div");
ad.id = 'div-gpt-ad-1484122037505-8';
ad.style.height = "250px";
ad.style.width="300px;";
inline.appendChild(advertentie);
inline.className = "inline";
var placeholder = document.getElementById("hidden-div-gpt-ad-1484122037505-8");
placeholder.parentNode.replaceChild(inline, tijdelijke aanduiding);
(functie () {
googletag.cmd.push(functie () {
googletag.display('div-gpt-ad-1484122037505-8');
});
})();
}
Hoe werkt apremilast bij psoriasis?
- Aangenomen wordt dat de vorming van psoriasisplaques wordt veroorzaakt door gedereguleerd immuunactiviteit in de huid.
- Is deregulering kan leiden tot een verhoging van de productie van pro-inflammatoir cytokinen Wat tumor necrose factorTNFa) -α, interleukine (IL)-17 en IL-23 die chronische ontsteking van de huid bevorderen opperhuid Y proliferatie van keratinocyten.
- Deze veranderingen veroorzaken roodheid, jeuk, epidermaal verdikking en geschubd platen.
- PDE4 is de overheersende intracellulair enzym dat cyclisch adenosinemonofosfaat (cAMP) afbreekt in een verscheidenheid van opruiend cellen, inclusief eosinofielen, neutrofielen, macrofagen, T-cellenY monocyten.
- PDE4 breekt cAMP af tot zijn inactieve AMP-vorm, waardoor deze mogelijk worden immune cellen om verhoogde niveaus van pro-inflammatoire cytokines en verlaagde niveaus van te produceren ontstekingsremmend cytokinen.
- Apremilast is een PDE4-remmer en voorkomt de afbraak van cAMP tot AMP, onderdrukt de productie van pro-inflammatoire cytokines, waaronder tumornecrosefactor TNF-α, IL-17 en interferon (IFN)-γ, en bevordert de productie van ontstekingsremmers.opruiend bemiddelaars zoals IL-10.
Hoe wordt apremilast toegediend?
De aanbevolen dosis apremilast is tweemaal daags 30 mg. Om het risico op gastro-intestinale symptomen te verminderen, wordt de aanbevolen dosis getitreerd volgens het volgende schema:
Dag 1: 10 mg 's ochtends
Dag 2: 10 mg 's morgens en 10 mg 's avonds
Dag 3: 10 mg 's morgens en 20 mg 's avonds
Dag 4: 20 mg 's morgens en 20 mg 's avonds
Dag 5: 20 mg 's morgens en 30 mg 's avonds
Vanaf dag 6: 30 mg tweemaal daags
Voor patiënten met ernstige nier tekort, is de aanbevolen dosis 30 mg eenmaal daags, getitreerd volgens uitsluitend het ochtendschema, zoals hierboven aangegeven.
- Apremilast kan met of zonder voedsel worden ingenomen.
- De tabletten mogen niet worden fijngemaakt, gebroken of gekauwd.
Link naar belangrijk bewijsmateriaal uit klinische onderzoeken met apremilast
Mogelijke geneesmiddelinteracties met apremilast
- Apremilast mag niet worden toegediend samen met medicijnen die de activiteit ervan verhogen lever cytochroom P450 enzymenbijvoorbeeld rifampicine, fenobarbital, carbamazepine, fenytoïne.
- Gelijktijdige toediening met rifampicine heeft geresulteerd in een vermindering van de circulerende apremilast met een verlies van effectiviteit.
- Niet significant farmacokinetiek Interacties werden waargenomen wanneer oraal apremilast 30 mg werd toegediend met orale anticonceptiva, ketoconazol of methotrexaat.
if (advertentieschermbreedte < 780 ) {
var inline = document.createElement("div");
var ad = document.createElement("div");
ad.id = 'div-gpt-ad-1484122037505-9';
ad.style.height = "250px";
ad.style.width="300px;";
inline.appendChild(advertentie);
inline.className = "inline";
var placeholder = document.getElementById("hidden-div-gpt-ad-1484122037505-9");
placeholder.parentNode.replaceChild(inline, tijdelijke aanduiding);
(functie () {
googletag.cmd.push(functie () {
googletag.display('div-gpt-ad-1484122037505-9');
});
})();
}
Wat zijn de bijwerkingen van apremilast?
Apremilast wordt goed verdragen. Geen monitoring of testen vereist.
- Diarree (17%), misselijkheid (17%) en infectie van de bovenste luchtwegen (9%) kwamen het meest voor. Bijwerkingen in klinische onderzoeken bij 1426 volwassen patiënten met matige tot ernstige plaque psoriasis behandeld met apremilast vergeleken met placebo.
- De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling met apremilast waren misselijkheid (1,6%), diarree (1,0%) en hoofdpijn (0,8%).
Gebruik tijdens de zwangerschap
- De incidenten van misvormingen en zwangerschapsverlies bij zwangerschappen bij mensen is niet vastgesteld voor apremilast.
- Apremilast mag alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel het potentiële risico voor de foetus rechtvaardigt.
- Bij embryofoetale dieren ontwikkelen studies, de toediening van apremilast aan cynomolgus apen gedurende organogenese resulteerde in een dosisgerelateerde stijging van het aantal embryo-foetale abortus/sterfte bij blootstellingsdoses die 2,1 keer hoger waren dan de maximaal aanbevolen dosis voor mensen therapeutisch dosis.
Gebruik bij zogende moeders
Het is niet bekend of apremilast of zijn metabolieten aanwezig zijn in de moedermelk.
pediatrisch gebruiken
De veiligheid en werkzaamheid van apremilast bij patiënten jonger dan 18 jaar zijn niet vastgesteld.
geriatrisch gebruik
Er werden geen algemene verschillen in de werkzaamheid en veiligheid van apremilast waargenomen bij oudere proefpersonen ≥65 jaar vergeleken met die jonger dan 65 jaar in klinische onderzoeken waarbij 1257 patiënten met plaque psoriasis betrokken waren.
Nierinsufficiëntie
Bij patiënten met ernstige nierinsufficiëntie (creatinineklaring minder dan 30 ml per minuut) moet de dosis apremilast worden verlaagd tot 30 mg eenmaal daags.
Leverfunctiestoornis
Er is geen dosisaanpassing van apremilast nodig bij patiënten met een matige of ernstige leverfunctiestoornis.
Allergische reacties
Apremilast is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid naar apremilast of een van de hulpstoffen in de formulering.
Depressie
Behandeling met apremilast gaat gepaard met een toename van depressie. Patiënten, hun verzorgers en hun families moeten worden gewaarschuwd voor de noodzaak om alert te zijn op het ontstaan of de verergering van depressie, zelfmoordgedachten of andere stemmingswisselingen, en als dergelijke veranderingen optreden, moeten ze contact opnemen met hun zorgverlener.
Gewichtsverlies
Patiënten die met apremilast worden behandeld, moeten hun lichaamsgewicht periodiek controleren. In klinische onderzoeken bij psoriasis trad een afname van het lichaamsgewicht tussen 5% en 10% op bij 12% (96/784) van de met apremilast behandelde proefpersonen, vergeleken met 5% (19/382) die met placebo werden behandeld.
Als onverklaard of klinisch significant gewichtsverlies optreedt, moet stopzetting van apremilast worden overwogen.