Efalizumab (Raptiva™) non è più disponibile. È stato ritirato dal mercato nel 2009. Questa pagina informativa è solo di interesse storico.
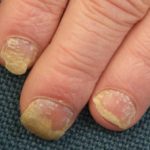
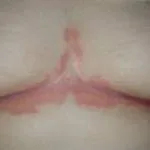
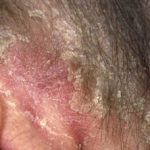
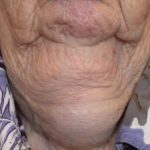
Efalizumab appartiene alla classe dei modificatori della risposta biologica chiamati Cellula T. bloccanti. È un trattamento efficace nei pazienti con malattia da moderata a grave targa psoriasi.
Come funziona?
Efalizumab è una forma murina geneticamente modificata proteina che ha lo scopo di bloccare Cellula T. attivazione e proliferazione legandosi ai recettori CD11a Cellule T.. Ciò impedisce il rilascio dei linfociti T citochine, Quali sono le primario causa del infiammazione, arrossamento, prurito e chiazze cutanee squamose caratteristiche della psoriasi.
Come viene somministrato?
I primi studi su efalizumab includevano la somministrazione endovenosa (IV) del farmaco. Tuttavia, un sottocutaneo (CAROLINA DEL SUD) formulazione è stato sviluppato ed è attualmente utilizzato. La somministrazione una volta alla settimana per un periodo di 12 settimane migliora in una certa misura la psoriasi in circa 501 TP1T di pazienti.
I miglioramenti nella psoriasi fatti dopo 12 settimane di trattamento possono essere mantenuti con dosi settimanali aggiuntive o dosi ogni due settimane.
Effetti collaterali
Efalizumab sembra essere ben tollerato. Gli effetti collaterali più comunemente riportati includevano mal di testa, nausea, brividi, dolore, febbre e non specifico infezione come il comune raffreddore. Questi si sono verificati più frequentemente dopo la prima iniezione e sono diminuiti con le dosi successive.
Rischi del trattamento
Efalizumab è un agente immunosoppressore e quindi aumenta suscettibilità per infezioni.
ATTENZIONE: 9 aprile 2009. Genetech ha deciso di ritirare volontariamente efalizumab (Raptiva) dal mercato statunitense a causa di un potenziale aumento del rischio di progressivo leucoencefalopatia multifocale (PML).
19 febbraio 2009. Il Centro per la valutazione e la ricerca sui farmaci della Food and Drug Administration (FDA) statunitense ha pubblicato un avviso di salute pubblica con informazioni sulla sicurezza aggiornate su Raptiva (efalizumamb) a causa di quattro segnalazioni di pazienti che assumevano questo farmaco che hanno sviluppato il raro pericolo di vita infezione cerebrale, leucoencefalopatia multifocale progressiva (PML) e altre infezioni.