Wat is cemiplimab?
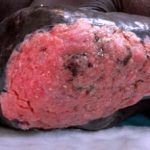
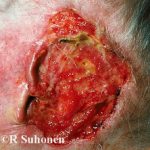
Cemiplimab (ook wel cemiplimab-rwlc genoemd; handelsnaam Libtayo®; Regeneron Pharmaceuticals Inc., New York, VS) is een monoklonaal antilichaam gebruikt voor patiënten met gevorderde huid geschubd cel carcinoom (VCA).
Cemiplimab is goedgekeurd door de Amerikaanse Food and Drug Administration (FDA) voor patiënten met metastatisch Cutane SCC of lokaal geavanceerde cutane SCC die geen kandidaat zijn voor curatieve chirurgie of curatieve bestraling.
Cemiplimab werd geëvalueerd door de FDA onder prioriteitsbeoordeling, die is gereserveerd voor geneesmiddelen die significante verbeteringen in veiligheid vertegenwoordigen of effectiviteit bij de behandeling van ernstige ziekten.
Cemiplimab is de eerste en enige behandeling die specifiek is goedgekeurd en beschikbaar is voor geavanceerde cutane SCC in de VS. Regeneron en Sanofi-Aventis (New Jersey, VS) zullen gezamenlijk cemiplimab op de markt brengen in de VS. Cemiplimab behoort tot een klasse van middelen die bekend staan als immuunmiddelen controle remmers, die werken door de immuunrespons van het lichaam op tumoren te versterken.
In april 2018 accepteerde het Europees Geneesmiddelenbureau (EMA) de aanvraag voor een vergunning voor het in de handel brengen van cemiplimab voor de behandeling van patiënten met gemetastaseerd cutaan PCC of lokaal gevorderd PCC die niet in aanmerking komen voor een operatie.
Het EMA-beoordelingsproces zal naar verwachting in de eerste helft van 2019 worden afgerond. Momenteel zijn er geen door het EMA goedgekeurde behandelingen voor geavanceerde cutane SCC. Momenteel worden ook in andere landen regelgevende toepassingen overwogen.
Cemiplimab is momenteel niet beschikbaar in Nieuw-Zeeland.
Bewijs uit klinische onderzoeken voor cemiplimab
Belangrijkste resultaten van het Advanced Cutane SCC Clinical Program
De FDA-goedkeuring van cemiplimab was gebaseerd op een gepoolde analyse van gegevens van a open, multicenter, neegerandomiseerd Fase II-studie bekend als EMPOWER-CSCC-1 (studie 1540) en twee uitbreidingscohorten van geavanceerde cutane SCC uit een multicenter, open-label, niet-gerandomiseerde fase I-studie (studie 1423). Samen vertegenwoordigden deze onderzoeken de grootste prospectieve dataset in geavanceerde cutane SCC.
De belangrijkste uitkomstmaten voor werkzaamheid voor EMPOWER-CSCC-1 en de twee SCC-huidexpansiecohorten waren bevestigd objectief responspercentage (ORR) zoals beoordeeld door een onafhankelijke centrale beoordeling (ICR) en beoordeelde responsduur door ICR.
Voor patiënten met gemetastaseerd cutaan SCC zonder extern zichtbaar doel verwondingen, De ORR werd bepaald aan de hand van de responsevaluatiecriteria in Stevig Tumoren (RECIST 1.1). Voor patiënten met uitwendig zichtbaar doel laesies (lokaal gevorderd en gemetastaseerd cutaan SCC), werd ORR bepaald met behulp van een samengesteld eindpunt waarin ICR-beoordelingen van radiologisch gegevens (RECIST 1.1) en digitale medische fotografie (criteria van de Wereldgezondheidsorganisatie).
De werkzaamheidsanalyse werd uitgevoerd toen alle patiënten de mogelijkheid hadden voor ten minste 6 maanden follow-up.
Patiënten kregen elke 2 weken intraveneus cemiplimab 3 mg/kg gedurende maximaal 48 weken in onderzoek 1423 of tot 96 weken in onderzoek 1540. De behandeling werd voortgezet tot ziekteprogressie, onaanvaardbaar toxiciteitof voltooiing van de geplande behandeling. Tumor Responsbeoordelingen werden elke 8 weken uitgevoerd.
Beide onderzoeken sloten patiënten uit met:
- auto immuun ziekte die nodig is systemisch behandeling met immunosuppressiva binnen 5 jaar
- Een gedegen orgelhistorie transplantatie
- Voorafgaande behandeling met anti-geprogrammeerde celdood eiwit Ligandblokkade 1 (PD-1) / geprogrammeerde dood 1 (PD-L1) antistoffen of ander immuun controle remmer therapieën
- Infectie met hiv
- Hepatitis B of hepatitis C
- Een prestatiestatus van de Eastern Cooperative Oncology Group ≥ 2.
De gecombineerde werkzaamheidsresultaten (n=108) van EMPOWER-CSCC-1 en de twee geavanceerde cutane SCC-expansiecohorten van de fase 1-studie zijn samengevat in de volgende tabel:
| Werkzaamheidseindpunten * | Gemetastaseerd CSCC (n = 75) | Lokaal geavanceerde CSCC (n = 33) | Gecombineerde CSCC (n = 108) |
| Bevestigde objectieve respons (ORR) | |||
| ORR (95% betrouwbaarheidsinterval [CI]) | 47% (35, 59) |
49% (31,67) |
47% (38, 57) |
| volledig responspercentage† | 5% | 0% | 4% |
| Gedeeltelijk responspercentage | 41% | 49% | 44% |
| Responsduur (DOR) | |||
| bereik in maanden | 3–15+ | 1–13 + | 1-15 + |
| Patiënten met DR > 6 maanden, n (%) | 21 (60%) | 10 (63%) | 31 (61%) |
* Mediaan duur van follow-up: gemetastaseerd HCC: 8,1 maanden; lokaal geavanceerde CSCC: 10,2 maanden; Gecombineerde CSCC: 8,9 maanden
† Omvat patiënten met volledige genezing van eerdere aantasting van de huid; Lokaal geavanceerde CSCC-patiënten op EMPOWER-CSCC-1 vereist biopsie om het volledige antwoord te bevestigen.
Bijwerkingen
Voor de gepoolde veiligheidsanalyse (n=163) van EMPOWER-CSCC-1 en de twee SCC-cohorten met geavanceerde huidexpansie, waren de meest voorkomende bijwerkingen die werden gemeld:
- Vermoeidheid (29%)
- Uitslag (25%)
- Diarree (22%).
Bij 5% van de patiënten werd cemiplimab definitief stopgezet vanwege de volgende bijwerkingen:
- longontsteking
- auto immuun myocarditis
- Hepatitis
- Aseptisch meningitis
- complexe regionale pijn syndroom
- Hoesten
- Spierzwakte
Echt Bijwerkingen het kwam voor bij 28% van de patiënten. De SAE's die optraden bij ten minste 2% van de patiënten waren:
- Cellulitis
- bloedvergiftiging
- Longontsteking
- longontsteking
- Urineweginfectie.
Bijwerkingen die optraden bij minder dan 10% patiënten met gevorderd cutaan SCC die cemiplimab kregen in onderzoek 1423 en onderzoek 1540 zijn onder andere:
- Uitslag
- pruritus
- Diarree
- Misselijkheid
- Constipatie
- Vermoeidheid
- bewegingsapparaat pijn
- Verminderde eetlust.
Laboratoriumtest afwijkingen
Graad 3 en 4 laboratoriumtestafwijkingen verergerd door baseren bij minder dan 1% van patiënten met gevorderd cutaan SCC die cemiplimab kregen in onderzoek 1423 en onderzoek 1540, staan hieronder vermeld.
Chemie
De afwijkingen omvatten:
- Verhoogd aspartaattransanimase (3%)
- Verhoging van de internationaal genormaliseerde ratio (2%)
- Hypoalbuminemie (1%).
Hematologie
De afwijkingen omvatten:
- lymfopenie (7%)
- Bloedarmoede (2%).
elektrolyten
De afwijkingen omvatten:
- Hypofosfatemie (4%)
- Hyponatriëmie (3%)
- hypercalciëmie (1%).
Cemiplimab - toekomstig potentieel
- Cemiplimab is een belangrijke nieuwe optie voor immunotherapie voor clinici om te helpen voorzien in een belangrijke onvervulde behoefte bij patiënten met vergevorderde cutane SCC die niet langer in aanmerking komen voor curatieve chirurgie of bestraling.
- Het veiligheidsprofiel van cemiplimab dat in de onderzoeken werd waargenomen, kwam overeen met dat van andere goedgekeurde anti-PD-1-middelen.
- Resultaten van klinische onderzoeken concludeerden dat cemiplimab een respons induceerde bij ongeveer de helft van de patiënten met gevorderd cutaan SCC.
- Cemiplimab wordt momenteel bestudeerd in fase III-onderzoeken voor verschillende indicaties, waaronder gemetastaseerde niet-kleincellige longen. kanker (NSCLC), geavanceerde NSCLC, cervicaal kanker, en basaal cel carcinoom.